(1)硫元素有多种化合价,可形成多种化合物.填写下表中的空白:
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | ______ | FeS2 | S | Na2S2O3 | ______ | SO3或H2SO4或Na2SO4 | Na2S2O8 |
(3)请按照浓度由大到小的顺序排列Na2SO3溶液中的离子:______.
Na2SO3溶液放置于空气中一段时间后,溶液的pH______(填“增大”“减小”或“不变”).(不考虑水的蒸发)原因是______.
(4)某同学设计如下实验流程探究Na2S2O3的化学性质.

实验①可说明Na2S2O3能发生水解,实验②③说明Na2S2O3具有______性.请你预测Na2S2O3还可能具有的化学性质(列举2条即可)______、______.
实验室中一瓶无色溶液,可能是盐酸溶液,但其标签已模糊不清.某同学为了验证该溶液是盐酸溶液,设计如下实验,请帮助其填写下列空白.
| 实验步骤 | 实验现象 | 解释、结论 |
| (1)取少量溶液于试管中, ______ | ______ | 说明此溶液为一种酸 |
| (2)取少量原溶液于另一个试管中,滴加______溶液和稀硝酸. | 有不溶于稀硝酸的白色沉淀生成 | 说明此溶液是盐酸溶液,反应的化学方程式为______ |
从废钒催化剂(主要成分有V2O5,VOSO4,K2SO4,SiO2等)中回收V2O5的一种生产流程示意图如下,请回答下列问题:
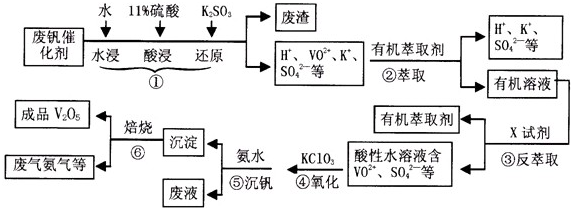
(1)步骤①中废渣的主要成分是______,③中X试剂为______;(均填化学式)
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是______;
(3)②③的变化过程可简化为(下式R表示VO 2+,HA表示有机萃取剂)
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
为提高②中萃取百分率,应采取的措施是______;
(4)请完成④中反应的离子方程式:
______ClO3-+______VO2++______H-+=______VO3++______+______
(5)25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如表
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(6)该工艺流程中,可以循环利用的物质有______.
 溶解
溶解 过滤
过滤 固体灼烧
固体灼烧






