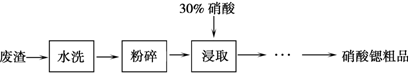
硝酸锶[Sr(NO3)2]常作为制备焰火、信号弹的原料.实验室以生产碳酸锶工厂的废渣(含SrCO3 38.40%,SrO12.62%,CaCO3 38.27%,BaCO3 2.54%,MgCO3 1.88%,其它不溶于硝酸的杂质6.29%)为原料制备硝酸锶粗品的部分实验过程如下:
两种盐的溶解度(g/100g水)
| 温度/℃物质 | 0 | 20 | 30 | 45 | 60 | 80 |
| Sr(NO3)2 | 28.2 | 40.7 | 47 | 47.2 | 48.3 | 49.2 |
| Ca(NO3)2?4H2O | 102 | 129 | 152 | 230 | 300 | 358 |
(2)由浸取后得到的混合物制备硝酸锶粗品的实验步骤依次为:①______;②______;③______;④洗涤,干燥.
(3)制得的硝酸锶粗品中含有少量Ca(NO3)2、Ba(NO3)2等杂质.实验室测定硝酸锶纯度的实验步骤如下:准确称取一定质量的硝酸锶样品,加入1:1无水乙醇与乙醚的混合液萃取硝酸钙,用水溶解分离硝酸钙后的样品,于250mL容量瓶中定容得样品溶液.准确移取25.00mL样品溶液,调节pH为7,加入指示剂,加热至微沸,立即用碳酸钠标准溶液滴定至终点.另取样品溶液用比浊法测得硝酸钡的含量.滴定过程中反应的离子方程式如下:
Sr2++C
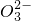 ═SrCO3↓ Ba2++C
═SrCO3↓ Ba2++C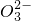 ═BaCO3↓
═BaCO3↓①滴定选用的指示剂为______,滴定终点观察到的现象为______.
②若滴定前样品中Ca(NO3)2没有除尽,所测定的硝酸锶纯度将会______(填“偏高”、“偏低”或“不变”).
 g
g g
g g
g g
g
 图中方框内区域表示所有的化学反应,大圈内区域表示离子反应,四个小圈分别表示四种基本反应类型.其中A~G分别表示图中不相互重叠的7个区域(B区域已用阴影标出).请分别对6个区域举出化学反应的实例(如果该实例属于离子反应,请写出离子方程式):
图中方框内区域表示所有的化学反应,大圈内区域表示离子反应,四个小圈分别表示四种基本反应类型.其中A~G分别表示图中不相互重叠的7个区域(B区域已用阴影标出).请分别对6个区域举出化学反应的实例(如果该实例属于离子反应,请写出离子方程式):







