某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示:
| 检测次数 | 溶液中检测出的物质 |
| 第1次 | KCl、K2SO4、Na2CO3、NaCl |
| 第2次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第3次 | Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测中,检测结果肯定不正确的是______
(2)仅取一次试剂检验出SO42-、CO32-和 Cl-的检测顺序是______
(3)在上述检测中:①检测 SO42-时,所用试剂是______②检测Cl- 时,反应的离子方程式是______.
下列相关实验不能表达预期目的是
| 相关实验 | 预期目的 | |
| A | 把等质量的两份同种大理石块中的一份研成粉末,在同温度下分别与等体积同浓度的盐酸反应,观察放出气体快慢 | 验证接触面积对化学反应速率的影响 |
| B | 把装有颜色相同的NO2与N2O4混合气体的小试管(密封)分别浸入热水和冷水中,观察试管中气体颜色变化 | 验证温度对化学平衡的影响 |
| C | 在蔗糖中加入适量的硫酸溶液,加热,充分水解后加入新制的氢氧化铜悬浊液并加热,观察沉淀的颜色 | 验证蔗糖水解产物中有醛基的存在 |
| D | 在装有同样浑浊的苯酚溶液的两个试管中,对其中一支试管加热,观察溶液是否变澄清 | 比较苯酚在不同温度下的溶解度 |
- A.A
- B.B
- C.C
- D.D
某校化学兴趣小组学生取纯净的Na2SO3?7H2O 50.00g,然后隔绝空气在600℃以上的强热至恒重(完全反应),分析及计算表明,恒重后的固体质量相当于无水亚硫酸钠的计算值,而且各元素的组成也与无水亚硫酸钠符合,但将它溶于水,却发现溶液的碱性大大高于期望值.经过仔细思考,这位同学猜想Na2SO3加热后发生了歧化反应从而很好解释这种反常现象,并设计了另一组实验,验证了自己的解释是正确的.
(1)加热Na2SO3?7H2O时为什么要隔绝空气(请用简要文字和化学方程式表示)?______.
(2)他对反应现象的解释是______(用化学方程式表达)
(3)溶液的碱性大大高于期望值的原因是:(用离子方程式表达)______.
(4)你估计他设计了什么实验来验证他的猜想.(请写出一种可行的实验方案):
| 实验试剂 | 操作 | 现象 | 结论 | 有关方程式 |
| ______ | ______ | ______ | ______ | ______ |
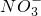
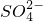 、Cl-
、Cl- 、
、