以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀p H | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
FeS2+14Fe3++______H2O═15Fe2++______SO42-+______.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为______.
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是______(几种离子沉淀的pH见表);滤液B可以回收的物质有(写化学式)______.
(5)已知每煅烧16g FeS2,放出106.5kJ热量,写出FeS2燃烧的热化学方程式______.该反应中被氧化的元素是______(写出元素符号并标出相应的化合价).
燃煤烟气的脱硫(除SO2)技术和脱硝(除NOx)技术是环境科学研究的热点.下表列出了目前科学家正致力于研究的3种燃煤烟气的脱硫技术和脱硝技术的原理.
| 方法Ⅰ | 用硫和氮的氧化物之间的相互转化联合进行的脱硫和脱硝技术 |
| 方法Ⅱ | 用乙烯作为还原剂将氮的氧化物还原为N2的脱硝技术 |
| 方法Ⅲ | 用电化学原理将SO2转化为重要的化工原料H2SO4的脱硫技术 |
NO2(g)+SO2(g)+H2O(l)=H2SO4(l)+NO(g)△H1
NO(g)+NO2(g)=N2O3(g)△H2
N2O3(g)+2H2SO4(l)=2NOHSO4(s)+H2O(l)△H3
4NOHSO4(s)+O2(g)+2H2O(l)=4H2SO4(l)+4NO2(g)△H4
2SO2(g)+O2(g)+2H2O(l)=2H2SO4(l)△H5
则△H1、△H2、△H3、△H4、△H5之间的关系为△H5=______.
(2)方法Ⅱ的脱硝机理如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示.
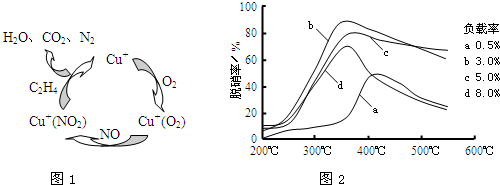
①出该脱硝过程中乙烯和NO2反应的化学方程式:______.
②达到最佳脱硝效果,应采取的条件是______.
(3)方法Ⅲ中用电化学原理将SO2转化为重要的化工原料H2SO4的装置如图(3)所示.
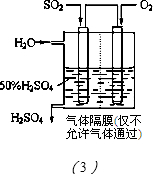
①写出通入SO2的电极的电极反应式:______.
②为使该脱硫过程稳定持续进行,硫酸溶液的浓度应维持不变,则通入的O2和加入的H2O的质量比为______.

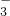 =Fe3++NO↑+2H2O
=Fe3++NO↑+2H2O