现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下表.据此,将甲和乙互相分离的最佳方法是
| 物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 水中 溶解性 |
| 甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 107 | 0.98 | 可溶 |
- A.萃取法
- B.升华法
- C.蒸馏法
- D.分液法
硫酸亚铁铵的化学式为(NH4)2SO4?FeSO4?6H2O,商品名为莫尔盐,可由硫酸亚铁与硫酸铵反应生成.一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4?7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4?FeSO4 | 17.2 | 21.6 | 28.1 |
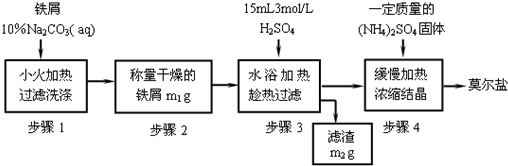
试回答下列问题:
(1)步骤1中加入10% Na2CO3溶液的主要作用是______;反应中铁屑过量是为了______.
(2)步骤3需要趁热过滤,原因是______.
(3)从步骤4到莫尔盐,必须进行的操作依次是______,析出的晶体常用______洗涤.
(4)若莫尔盐的饱和溶液中有水20克,当温度从30℃降至10℃,最多析出莫尔盐的质量是______(选填编号).
A.2.18g B.大于2.18g C.小于 2.18g D.无法确定
(二)称取质量为1.96g的莫尔盐制成溶液.用未知浓度的酸性KMnO4溶液进行滴定.
(1)已知MnO4-被还原为Mn2+,试写出该滴定反应的离子方程式______.
(2)判断该反应到达滴定终点的现象为______.
(3)假设到达滴定终点时,用去VmL酸性KMnO4溶液,则该酸性KMnO4溶液的浓度为______mol/L.
从含镍废催化剂中可回收镍,其流程如下:

某油脂化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)“碱浸”的目的是除去______.
(2)“酸浸”时所加入的酸是______(填化学式).酸浸后,滤液②中可能含有的金属离子是______.
(3)“调pH为2~3”的目的是______.
(4)产品晶体中有时会混有少量绿矾(FeSO4?7H2O),可能是由于生产过程中______.
(5)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是______.
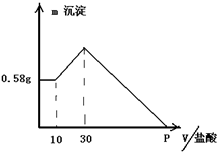 Ⅰ把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得浊液中,逐滴加入1mol/L盐酸,加入盐酸的体积和生成沉淀的质量如图所示.
Ⅰ把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得浊液中,逐滴加入1mol/L盐酸,加入盐酸的体积和生成沉淀的质量如图所示.