氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2?xH2O).

(1)实验室采用如图所示装置,可使粗铜与Cl2反应转化为固体1(部分加热仪器和夹持装置已略去).该装置中仪器a的名称是______.装置b中发生反应的离子方程式是______.该装置存在一定的安全隐患,消除该安全隐患的措施是______.

(2)操作Ⅱ中应控制的pH范围为______,其目的是______.
已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH | |
| Cu2+ Fe2+ Fe3+ | 4.7 4.0 1.9 | 6.7 9.0 3.2 |
(4)若制备的氯化铜晶体经检验含有FcCl2,其原因可能是______,试提出两种不同的改进方案:①______;②______.
元素价态的多样性使得物质世界变得更加丰富多彩,请参照示例,用一个化学方程式表示下列核心元素的价态变化,并回答问题:
核心元素的价态变化 | 请用一个化学方程式表示 | 回答问题 |
示例: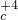 → →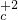 ← ← | CO2+C=2CO | 在高炉炼铁中的作用:提供还原剂 |
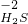 → →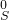 ← ←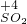 | ①________ | 反应的现象是②________ |
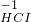 ← ←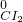 → →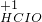 | ③________ | 氧化剂、还原剂分别为④________ |
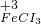 → →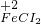 ← ←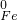 | ⑤________ | 溶液颜色变化为⑥________ |
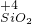 → →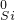 | ⑦________ | 反应的工业用途是⑧________ |
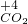 → →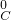 | ⑨________ | 反应现象为⑩________ |
下表中评价合理的是
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与稀硝酸反应: 2Fe3O4+18H+=6Fe3++H2↑+8H2O | 正确 |
| B | 向碳酸镁中加入稀盐酸: CO2-3+2H+=CO2↑+H2O | 错误,碳酸镁不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO2-4=BaSO4↓ | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为1:2 |
- A.A
- B.B
- C.C
- D.D