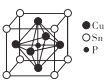
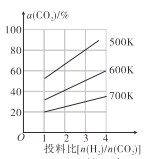
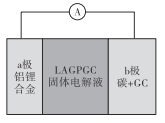
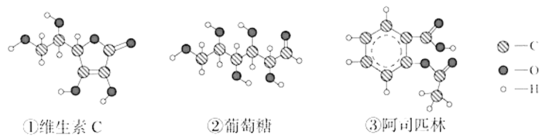
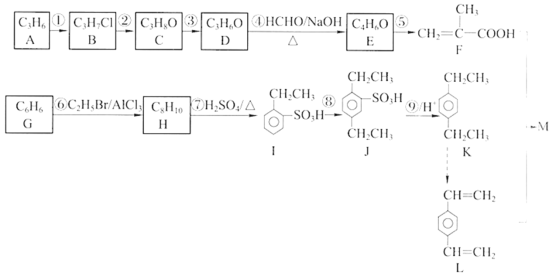
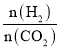0 203247 203255 203261 203265 203271 203273 203277 203283 203285 203291 203297 203301 203303 203307 203313 203315 203321 203325 203327 203331 203333 203337 203339 203341 203342 203343 203345 203346 203347 203349 203351 203355 203357 203361 203363 203367 203373 203375 203381 203385 203387 203391 203397 203403 203405 203411 203415 203417 203423 203427 203433 203441 203614