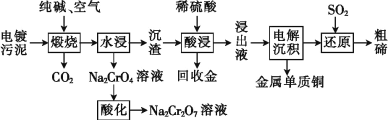
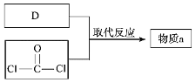
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。某工厂对工业污泥中Cr(III)回收与再利用工艺流程如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
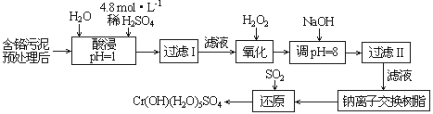
已知:常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH(开始沉淀的pH按金属阳离子浓度为1.0mol·L-1计算)和完全沉淀时溶液的pH,见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.5 | —— | —— | 4.7 | —— |
沉淀完全时的pH | 3.2 | 9.7 | 11.1 | 8 | 6.7 | 9(>9溶解) |
重铬酸根离子(Cr2O72-)在溶液中存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
(1)该工厂对工业污泥中Cr(+3价)回收与再利用工艺流程中,其中一步存在氢氧化铁的沉淀溶解平衡:Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq),其溶度积常数表达式为Ksp=__。
Fe3+(aq)+3OH-(aq),其溶度积常数表达式为Ksp=__。
(2)酸浸时,为了提高浸取率可采取的措施是__(至少答一点)。
(3)加入H2O2的作用是__。调节溶液的pH=8是为了除去__离子。
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的的杂质离子是__。
【题目】某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ |
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
Ⅱ |
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I和IO3的形式存在。酸性条件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3,理由是______。欲证明实验Ⅱ所得溶液中存在IO3,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。