【题目】25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀
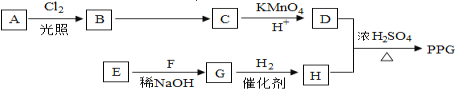
【题目】由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
完成下列填空:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和______________。(填序号)
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.泥三角
(2)在“加酸岐化”时不宜用硫酸的原因是__________;不宜用盐酸的原因是____________。反应之后得到高锰酸钾的步骤是:过滤、蒸发结晶、趁热过滤。该步骤能够得到高锰酸钾的原理是____________。
(3)采用电解法也可实现K2MnO4的转化,2K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为_________________。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为_________________。
(4)草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
已知涉及到的反应:
Na2C2O4+H2SO4=H2C2O4(草酸)+Na2SO4 ,
5H2C2O4+ 2MnO4—+6H+=2Mn2++10CO2↑+ 8H2O
Na2C2O4的式量:134 KMnO4的式量:158)
Ⅰ.称取0.80 g 的高锰酸钾产品,配成50mL溶液。
Ⅱ.称取0.2014 gNa2C2O4,置于锥形瓶中,加入蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ.将瓶中溶液加热到75~80℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。消耗高锰酸钾溶液8.48mL。
a.判断达到滴定终点的标志是____________________________。
b.样品中高锰酸钾的质量分数为______________(保留3位小数)。
c.加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度__________。(填“偏高”、“偏低”或“无影响”)
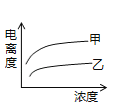
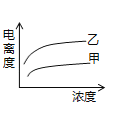
d.将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,其原因可能为_______________。