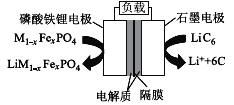
【题目】无水氯化铝在生产、生活中应用广泛。工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
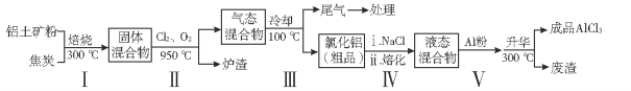
已知:
物质 |
|
|
|
|
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
回答下列问题:
(1)步骤I中焙烧使固体水分挥发、气孔数目增多,其作用是_________________(只要求写出一种)。
(2)请写出步骤I中反应的方程式:________________________、______________________
(3)步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为____________________。
(4)氯化铝粗品中的杂质主要是___________(写化学式)。结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_____________________________。
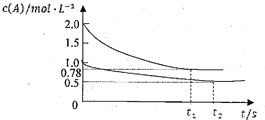
【题目】I、实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |

(1)不能用铁丝搅拌棒代替环形玻璃搅拌棒的理由是_______
(2)经数据处理,测得中和热为56.8 kJ·mol-1其热化学方程式为:___________
II.实验室制备硝基苯实验装置和步骤如下:(实验步骤)

取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝基苯18.00 g。请回答:
(1)装置B的名称是________,装置C的作用是________________。
(2)实验室制备硝基苯的化学方程式是____________________________。
(3)为了使反应在50~60 ℃下进行,常用的方法是__________。
(4)在洗涤操作中,第二次水洗的作用是____________________。