【题目】请应用化学反应原理的相关知识解决下列问题:
![]() 已知NaCl的溶解热为
已知NaCl的溶解热为![]() 吸热
吸热![]()
![]()
![]()
![]()
![]()
写出钠在氯气中燃烧的热化学方程式:__________。
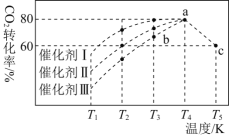
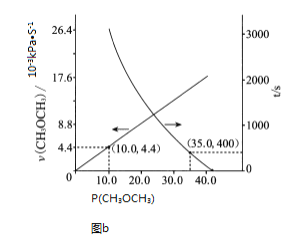
![]() 一定条件下,在
一定条件下,在![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 发生反应:
发生反应:![]() ,如图所示为反应体系中
,如图所示为反应体系中![]() 的平衡转化率与温度的关系曲线。已知在温度为
的平衡转化率与温度的关系曲线。已知在温度为![]() 的条件下,该反应
的条件下,该反应![]() 达到平衡状态;
达到平衡状态;
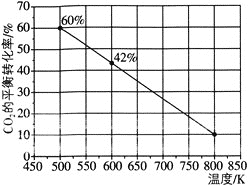
![]() 该反应是________
该反应是________![]() 填“吸热”或“放热”
填“吸热”或“放热”![]() 反应。
反应。
![]() 在
在![]() 时段反应速率
时段反应速率![]() 为_________。
为_________。
![]() 若改充入
若改充入![]() 和
和![]() ,图中的曲线会_________
,图中的曲线会_________![]() 填“
填“![]() 。
。
![]() 根据下表数据回答问题:
根据下表数据回答问题:
表1 ![]() 时浓度为
时浓度为![]() 两种溶液的pH
两种溶液的pH
溶质 | NaClO |
|
pH |
|
|
表2 ![]() 时两种酸的电离平衡常数
时两种酸的电离平衡常数
|
| |
|
|
|
|
|
|
![]() 根据表1能不能判断出
根据表1能不能判断出![]() 与HClO酸性强弱?_____________
与HClO酸性强弱?_____________![]() 填“能”或“不能”
填“能”或“不能”![]() 。
。
![]() 溶液中离子浓度由大到小的顺序为__________。
溶液中离子浓度由大到小的顺序为__________。
![]() 溶液和
溶液和![]() 溶液反应的离子方程式为________。
溶液反应的离子方程式为________。
![]() 已知:
已知:![]() 时,
时,![]() 、
、![]() ;AgCl为白色沉淀,
;AgCl为白色沉淀,![]() 为砖红色沉淀。
为砖红色沉淀。![]() 时,向
时,向![]() 和
和![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 溶液至过量且不断搅拌,实验现象为__________。
溶液至过量且不断搅拌,实验现象为__________。
【题目】工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇。
![]() 已知:
已知:![]()
![]()
![]()
![]()
![]()
![]()
则碳与水蒸气反应![]() 的
的![]() ________。
________。
![]() 工业上也可以仅利用碳和水蒸气反应得到的
工业上也可以仅利用碳和水蒸气反应得到的![]() 和
和![]() 进一步合成甲醇,反应方程式为:
进一步合成甲醇,反应方程式为:![]()
![]()
![]() 工业上此生产过程中
工业上此生产过程中![]() 和
和![]() 的转化率________
的转化率________![]() 填“前者大”、“后者大”、“一样大”或“无法判断”
填“前者大”、“后者大”、“一样大”或“无法判断”![]() ;为了既提高甲醇的产率又加快反应速率,可以采取的措施是________。
;为了既提高甲醇的产率又加快反应速率,可以采取的措施是________。
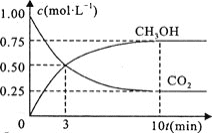
![]() 在一恒温恒容密闭容器中充入
在一恒温恒容密闭容器中充入![]() 和
和![]() 进行上述反应。测得
进行上述反应。测得![]() 和
和![]() 浓度随时间变化如图所示。该温度下的平衡常数为________
浓度随时间变化如图所示。该温度下的平衡常数为________![]() 保留三位有效数字
保留三位有效数字![]() 。
。
![]() 改变温度,使反应
改变温度,使反应![]() 中的所有物质都为气态。起始温度体积相同
中的所有物质都为气态。起始温度体积相同![]() 、
、![]() 密闭容器
密闭容器![]() ,反应过程中部分数据见下表:
,反应过程中部分数据见下表:
反应时间 |
|
|
|
| |
反应Ⅰ 恒温恒容 |
| 2 | 6 | 0 | 0 |
|
| ||||
| 1 | ||||
| 1 | ||||
反应Ⅱ 绝热恒容 |
| 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、反应Ⅱ对比:平衡常数![]() Ⅰ
Ⅰ![]() ________
________![]() Ⅱ
Ⅱ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ;平衡时
;平衡时![]() 的浓度
的浓度![]() ________
________![]() Ⅱ
Ⅱ![]() 。
。
![]() 对反应
对反应![]() ,前
,前![]() 内的平均反应速率
内的平均反应速率![]() ________,若
________,若![]() 时只向容器中再充入
时只向容器中再充入![]() 和
和![]() ,则平衡________移动
,则平衡________移动![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 。
。
【题目】甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下含成甲醇,发生的反应为:![]() ?
?![]() 已知CO、
已知CO、![]() 、
、![]() 的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则
的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则![]() ______。
______。![]() 在一容积为2L的恒容密闭容器中加入
在一容积为2L的恒容密闭容器中加入![]() CO和
CO和![]()
![]() ,发生如下反应:CO
,发生如下反应:CO![]() ,实验测得
,实验测得![]() 和
和![]() 下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
时间 | 10min | 20min | 30min | 40min | 50min | 60min |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]() 由上述数据可以判断:
由上述数据可以判断:![]() ______
______![]()
![]() 时,
时,![]() 的平均反应速率
的平均反应速率![]() ______。
______。![]() 该反应
该反应![]() 达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______
达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______![]() 选填编号
选填编号![]() 。
。
A 改用高效催化剂![]() 升高溫度
升高溫度![]() 缩小容器体积
缩小容器体积 ![]() 分离出甲醇
分离出甲醇 ![]() 增加CO的浓度
增加CO的浓度![]() 若保持
若保持![]() 不变,起始时加入CO、
不变,起始时加入CO、![]() 、
、![]() 的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。
的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。![]() 当反应在
当反应在![]() 达到20min时,控制体积不变,迅速将
达到20min时,控制体积不变,迅速将![]() ,
,![]() ,
,![]() 同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中
同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中![]() 浓度的变化趋势曲线:______
浓度的变化趋势曲线:______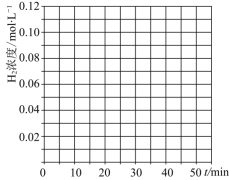
![]() 在以
在以![]() 为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。
为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。![]() 燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比
燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比![]()