【题目】二甲醚又称甲醚,简称 DME,熔点![]() ,沸点
,沸点![]() ,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(
,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(![]() )制备二甲醚的反应原理如下:
)制备二甲醚的反应原理如下:
①![]()
②![]()
回答下列问题:
(1)已知:![]() ,若由合成气(
,若由合成气(![]() ) 制备
) 制备 ![]() ,且生成
,且生成![]() ,其热化学方程式为_______________。
,其热化学方程式为_______________。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入![]() 和
和![]() . 5min达到平衡,平衡时测得
. 5min达到平衡,平衡时测得![]() ,
,![]() ,此时
,此时![]() 的转化率为___________。用
的转化率为___________。用 ![]() 表示反应①的速率是_____________
表示反应①的速率是_____________![]() ,可逆反应②的平衡常数
,可逆反应②的平衡常数 ![]() =_______________________
=_______________________
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数![]() 值变小,则下列说法正确的是_________________ 。
值变小,则下列说法正确的是_________________ 。

A. 平衡向正反应方向移动
B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变
D. 容器中![]() 的体积分数减小
的体积分数减小
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入![]() 和
和![]() 进行反应①,平衡时
进行反应①,平衡时![]() 和
和![]() 的转化率如图所示,则a=________ (填数值)。
的转化率如图所示,则a=________ (填数值)。
(5)用活性炭还原法处理氮氧化物的有关反应为:![]() 。向恒容密闭容器中加入一定量的活性炭和
。向恒容密闭容器中加入一定量的活性炭和![]() ,恒温(
,恒温(![]() )时,各物质的浓度随时间的变化如下表:
)时,各物质的浓度随时间的变化如下表:
浓度/ 时间/min |
|
|
|
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
在31 min时,若只改变某一条件使平衡发生移动,40 min,50 min时各物质的浓度如上表所示,则改变的条件是__________________。
在51 min时,保持温度和容器体积不变再充入![]() 和
和![]() ,使二者的浓度均增加至原来的两倍,此时化学平衡__(填“正向移动”、“逆向移动”或“不移动”)。
,使二者的浓度均增加至原来的两倍,此时化学平衡__(填“正向移动”、“逆向移动”或“不移动”)。
【题目】碳氧化物研究
![]() 和
和![]() 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇:![]() ,现在体积为1L的恒容密闭容器
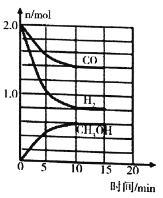
,现在体积为1L的恒容密闭容器![]() 图甲
图甲![]() 中通入1molCO和
中通入1molCO和![]() ,测定不同时间、不同温度
,测定不同时间、不同温度![]() 下容器中CO的物质的量,如表:
下容器中CO的物质的量,如表:

0min | 10min | 20min | 30min | 40min | |
| 1mol |
|
|
|
|
| 1mol |
|
| a | a |
请回答:
![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]() ,理由是______。已知
,理由是______。已知![]() 时,第20min时容器内压强不再改变,此时
时,第20min时容器内压强不再改变,此时![]() 的转化率为______,该温度下的化学平衡常数为______。
的转化率为______,该温度下的化学平衡常数为______。
![]() 若将1molCO和
若将1molCO和![]() 通入原体积为1L的恒压密闭容器
通入原体积为1L的恒压密闭容器![]() 图3乙
图3乙![]() 中,在
中,在![]() 下达到平衡,此时反应的平衡常数为______;若再向容器中通入
下达到平衡,此时反应的平衡常数为______;若再向容器中通入![]() ,重新达到平衡后,
,重新达到平衡后,![]() 在体系中的百分含量______
在体系中的百分含量______![]() 填“变大”或“变小”或“不变”
填“变大”或“变小”或“不变”![]() 。
。
![]() 一定条件下也可用NaOH溶液与CO反应生成甲酸钠,进一步反应生成甲酸来消除CO污染。常温下将amol的CO通入
一定条件下也可用NaOH溶液与CO反应生成甲酸钠,进一步反应生成甲酸来消除CO污染。常温下将amol的CO通入![]() NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液
NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液![]() 假设溶液体积不变
假设溶液体积不变![]() ,测得溶液中
,测得溶液中![]() ,则该混合溶液中甲酸的电离平衡常数
,则该混合溶液中甲酸的电离平衡常数![]() ______
______![]() 用含a和b的代数式表示
用含a和b的代数式表示![]()