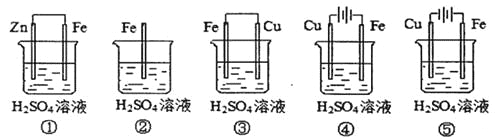
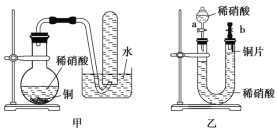
【题目】![]() 是一种重要的化工原料,被广泛应用在工农业生产中。请运用所学知识解决下列问题:
是一种重要的化工原料,被广泛应用在工农业生产中。请运用所学知识解决下列问题:
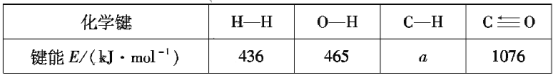
已知反应:![]()
![]()
![]()
![]() 工业制取炭黑的方法之一是将甲烷隔绝空气加热到
工业制取炭黑的方法之一是将甲烷隔绝空气加热到![]() 进行裂解。该反应的热化学方程式为______。
进行裂解。该反应的热化学方程式为______。
![]() 容积固定为1L的密闭容器内充入
容积固定为1L的密闭容器内充入![]() 和
和![]() ,保持
,保持![]() 发生反应
发生反应![]() ,用压力计监测反应过程中容器内压强的变化如下表:
,用压力计监测反应过程中容器内压强的变化如下表:
反应时间 | 0 | 5 | 10 | 15 | 20 | 25 |
压强 |
|
|
|
|
|
|
则反应从开始到20min时,以CO浓度变化表示的平均反应速率![]() ______。
______。
![]() 对于反应
对于反应![]() 来说:
来说:
![]() 时,平衡常数
时,平衡常数![]() 。
。![]() 测得密闭容器中各物质达到平衡时物质的量浓度分别为:
测得密闭容器中各物质达到平衡时物质的量浓度分别为:![]() ,
,![]() ,
,![]() ,
,![]() ,则
,则![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,判断依据是______。
,判断依据是______。
![]() 下列措施有利于提高反应混合气中
下列措施有利于提高反应混合气中![]() 含量的是______。
含量的是______。
A.使用催化剂 ![]() 升高温度
升高温度 ![]() 及时导出CO
及时导出CO![]() 增大反应体系的压强
增大反应体系的压强
![]() 一定条件下,将
一定条件下,将![]() 与
与![]() 按物质的量之比1:1置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是______。
按物质的量之比1:1置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是______。
A.![]()
![]()
B.体系中混合气体密度不变
C.![]() 与
与![]() 的转化率相等
的转化率相等
D.![]() 与
与![]() 物质的量之比不再改变
物质的量之比不再改变
E.反应体系压强不再改变
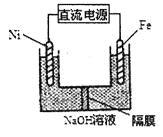
![]() 以甲烷为燃料的新型电池得到广泛应用。下图是甲烷燃料电池工作原理的示意图。
以甲烷为燃料的新型电池得到广泛应用。下图是甲烷燃料电池工作原理的示意图。
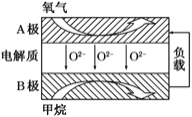
![]() 极上的电极反应式为______。
极上的电极反应式为______。
![]() 以该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到
以该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到![]() 标准状况
标准状况![]() 气体时,消耗甲烷的体积为______
气体时,消耗甲烷的体积为______![]() 标准状况
标准状况![]() 。
。
【题目】下表为元素周期表的一部分。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① | ||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | ||
三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
四 | |||||||
(1)表中元素__
(2)表中元素⑦的原子结构示意图为__,在周期表中的位置为____
(3)表中元素⑥⑩的氢化物的稳定性顺序为__(填写化学式,下同)。
(4)表中元素⑩的最高价氧化物对应水化物的酸性:__。
(5)表中元素②和⑦的最高价氧化物对应水化物的碱性:__。