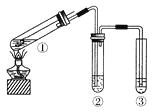
【题目】以炼锌厂的烟道灰![]() 主要成分为ZnO,另含少量
主要成分为ZnO,另含少量![]() 、CuO、
、CuO、![]() 、MnO等
、MnO等![]() 为原料可生产草酸锌晶体ZnSO4·2H2O,摩尔质量为189g/mol。
为原料可生产草酸锌晶体ZnSO4·2H2O,摩尔质量为189g/mol。

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
请问答下列问题:
(1)滤渣A的主要成分为_________,滤渣B的主要成分为_______________。
(2)除锰过程中产生![]() 沉淀的离子方程式为_______________________。
沉淀的离子方程式为_______________________。
(3) ①除铁![]() 部分
部分![]() 可能被除去
可能被除去![]() 时加入ZnO控制反应液pH的范围为______________。
时加入ZnO控制反应液pH的范围为______________。
②若某溶液中含有![]() ,可能含有
,可能含有![]() ,请设计实验证明
,请设计实验证明![]() 的存在。________。
的存在。________。
(4)沉淀后要获得干燥纯净草酸锌晶体,需进行的操作是_______________。
(5)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,![]() 范围内,发生反应的化学方程式为_________________。
范围内,发生反应的化学方程式为_________________。

【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
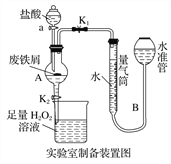
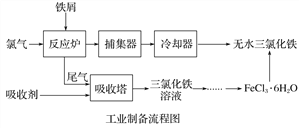
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应。
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸;
Ⅱ.当……时,关闭弹簧夹K1,打开活塞K2,当A中溶液完全进入烧杯后关闭活塞a;
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是_____________________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________。
(3)从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是加入______________后__________________、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:______________________。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式(相对原子质量:Cl-35.5、Fe-56)为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100 mL溶液;取出10.00 mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol·L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-=2I-+S4O62-)。
①滴定终点的现象是________________________________________________;
②样品中氯化铁的质量分数为__________________________。
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为____。
(2)如图所示,表示NO2变化曲线的是____。用O2表示0~2s内该反应的平均速率v=____。

(3)能说明该反应已达到平衡状态的是____(填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变