【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图所示。已知达平衡后,降低温度,A的体积分数将减小。
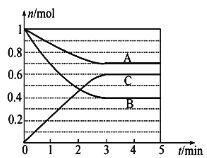
(1)该反应的化学方程式为__________。
(2)该反应的反应速率v随时间t的关系如图所示:
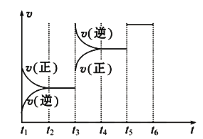
①根据上图判断,在t3时刻改变的外界条件是____________。
②A的转化率最大的一段时间是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
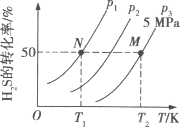
(1)△H___ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为____。
(3)图中M点的平衡常数Kp =____MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___。
【题目】I.CO、CO2的应用和治理是当今社会的热点问题。
CO工业上可用于高炉炼铁,发生如下反应: 1/3Fe2O3(s) + CO(g)![]() 2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的正反应为_____反应(填“放热”或“吸热”),欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是____(选填序号)
a.及时吸收或移出CO2 b.增大反应体系的压强
c.用更高效的催化剂 d.粉碎矿石,增大接触面积
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时
FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时![]() 增大的是______(选填编号)。
增大的是______(选填编号)。
a.升高温度 b.增大压强
c.充入一定量CO d.再加入一些铁粉
II.合成尿素的反应为:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g)+Q(Q>0)。
CO(NH2)2(s)+H2O(g)+Q(Q>0)。
一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达到平衡,测得容器中CO2的浓度为0.05molL-1 。
完成下列填空:
(1)平均反应速率υ(NH3)=____________。
(2)下列描述中能说明上述反应已达平衡的是_________。(填序号)
a.2υ正(NH3)=υ逆(H2O) b.气体的平均相对分子质量不随时间而变化
c.NH3和CO2的比例保持不变 d.气体的压强不再发生变化
(3)为提高尿素的产率,工业上用该反应生产尿素时,合适的反应条件是_______。(填序号)
a.200℃ b.800℃ c.101 kPa d.24000 kPa
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
完成下列填空:
(1)硫原子的核外电子排布式为__,硫原子的核外电子占有__个轨道,Z元素在元素周期表中的位置为__,Y原子核外有______种能量不同的电子。
(2)H2S分子中H-S键键角为92°,说明H2S分子是__(填“极性”“非极性”)分子。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是__。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫单质得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成0.1molX的最高价化合物,恢复至室温,放热68.7kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式___。
(5)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式解释产生该现象的原因:___;在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因___。
【题目】一定量的铁粉在氯气中充分燃烧后,将所得固体完全溶于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是____________________________。
(2)推测A中可能含有的金属阳离子:①Fe3+;②只有Fe2+;③______。
甲同学为探究溶液的组成,实验如下:
实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
取少量溶液A于试管中,加入KSCN溶液。 | ________ | 假设②不成立,假设①或③成立;反应的离子方程式是_____________ 。 |
(3)乙同学继续探究溶液A的组成。
查阅资料:16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:另取少量溶液A于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4紫色褪去。
实验结论:__________(填写字母序号)。
a.可能有Fe2+ b.可能无Fe2+ c.一定有Fe2+
(4)结论:A中含有的阳离子是_________,简述理由:________________。
