【题目】过氧化钙可用于治理赤潮、应急供氧等。已知:过氧化钙,为白色或淡黄色结晶粉末,难溶于水,不溶于乙醇、乙醚等有机溶剂,常温下干燥品很稳定,能溶于稀酸生成过氧化氢。某小组同学探究过氧化钙的制法和性质:
(1)甲、乙两位同学设计的过氧化钙实验室制法如下,其中产率较低的是______(填A、B)
方法A Ca (OH)2 (s) + H2O2 CaO2 (s) + 2H2O
方法B CaCl2 (s) + H2O2 CaO2 (s) + 2HCl
方法A所得产品中纯度不高,所含杂质主要是 ___________(填化学式)
如果不加入稳定剂,则两种方法都需在5℃以下进行实验,原因可能是______________。
(2)丙同学认为CO2、SO2与过氧化钙的反应原理相同,丁同学认为SO2具有较强的还原性,而CO2没有,故而反应原理不相同。他们设计了如下实验装置,通过测量装置E中所得气体体积判断反应情况:
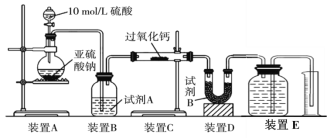
①试剂B的作用是____________________。
②若实验中SO2足量,且与过氧化钙充分反应,取反应后的固体进行探究,以验证过氧化钙与SO2反应的生成物。若SO2未被氧化,则反应的化学方程式为:______________________________。
③装置E中收集到的氧气体积为V L(已换算成标准状况下),若SO2完全被氧化,则V =______。
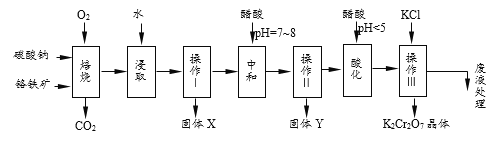
(3)某工厂利用电石渣(主要成分为氢氧化钙)生产过氧化钙的生产流程如下:
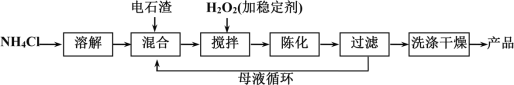
用上述方法制备过氧化钙(CaO2·8H2O),搅拌步骤的化学方程式是______________。
②某小组釆用单变量法确定温度、H2O2浓度对产率的影响,结果如下,则实际生产应选择的适宜条件为__________。
H2O2 % | 30% | 25% | 20% | 15% | 10% | 5% | ||||||
产率 | 60.40 | 62.42 | 64.54 | 63.20 | 63.10 | 62.40 | ||||||
温度(℃) | 50 | 40 | 30 | 20 | 10 | 0 | ||||||
产率 | 43.24 | 52.80 | 64.54 | 63.80 | 60.45 | 52.40 | ||||||
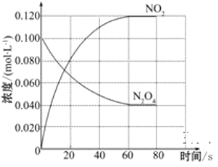
【题目】⑴可逆反应FeO(s)+CO(g)Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T/K | 938 | 1100 |
K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量________;充入氦气,混合气体的密度________(填“增大”“减小”或“不变”)。
⑵常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________ (填编号)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②据上表数据,请你判断下列反应不能成立的是________(填编号)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN C.CO2+H2O+2NaClO=Na2CO3+2HClO
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D