【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:

(1)X难溶于水、易溶于有机溶剂,其晶体类型为________。
(2)M所含元素的电负性由大到小顺序为_______,N原子以_____轨道与O原子形成σ键。
(3)上述反应中断裂和生成的化学键有______(填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
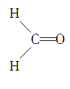
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_____。

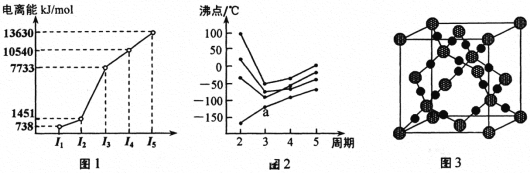
(5)基态Cu2+的外围电子排布式为________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如图所示。
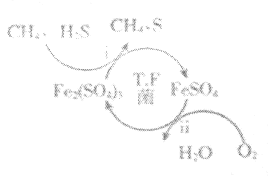
(1)过程i中H2S发生了___(填“氧化”或“还原”)反应。
(2)过程ii的离子方程式是___。
(3)已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.4 | 2.7 | 3.0 |
Fe2+氧化速率/(g·L-1·h-1) | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.2 | 5.6 |
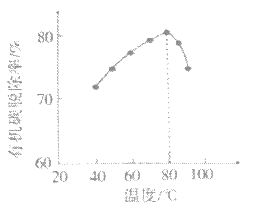
请结合以上信息,判断工业脱硫应选择的最佳pH范围,并说明原因:___。
II.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。
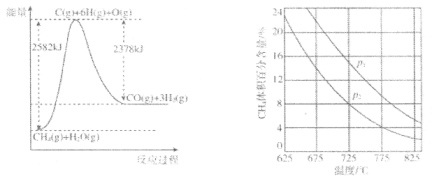
(4)①该过程的热化学方程式是___。
②比较压强p1和p2的大小关系:p1___p2(选填“>”“<”或“=”)。
III.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
IV.H2提纯:将CO2和H2分离得到H2的过程示意图如图。
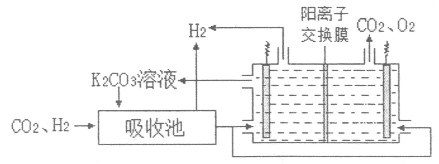
(5)①吸收池中发生反应的离子方程式是___。
②结合电极反应式,简述K2CO3溶液的再生原理:___。