【题目】元素单质及其化合物有广泛用途,请回答下列问题:
(1)第三周期元素中,钠原子核外有_______种能量不同的电子;氯原子的最外层电子排布式为______________;由这两种元素组成的化合物的电子式为__________。
(2)下列气体能用浓硫酸干燥的是________。
A.NH3 B.HI C.SO2 D.CO2
(3)请用一个实验事实说明钠与镁的金属性强弱________________________________。
(4)KClO3可用于实验室制O2,若不加催化剂,400 ℃时可分解生成两种盐,化学方程式为:KClO3 ![]() KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
(5)已知:
化合物 | MgO | MgCl2 |
类型 | 离子化合物 | 离子化合物 |
熔点/℃ | 2800 | 714 |
工业上电解MgCl2制单质镁,而不电解MgO的原因是________________________________。
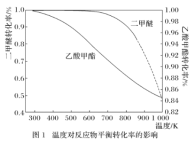
【题目】丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如图所示:

制取的反应原理:CH2 =CHCOOH + HOCH3![]() CH2=CHCOOCH3 + H2O。
CH2=CHCOOCH3 + H2O。
可能用到的信息如下表:
沸点 | 溶解性 | 性质 | |
丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
(一)制取丙烯酸甲酯
①取0.14mol丙烯酸、0.2mol的甲醇、少量的浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,加热。
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性。
③分液,取上层油状液体,再加无水Na2SO4后,蒸馏,收集馏分。
(二)检验丙烯酸甲酯的产率,设计如下实验:
①将收集的油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol·L-1的KOH溶液10.00 mL,加热使之完全水解。
②用酚酞作指示剂,向冷却后的溶液中滴加0.5 mol·L-1的盐酸,滴定到终点时共消耗盐酸20.00 mL。
回答下列问题:
(1)仪器b的名称是_________________。
(2) 浓硫酸的作用_________________。
(3) 搅拌棒的作用:___________ ; 5% Na2CO3溶液的作用:______________。
(4) 加无水Na2SO4的作用:_____________ ;蒸馏收集___________温度的馏分。
(5) 滴定终点的判断:_________________________________________________。
(6)计算本次酯化反应中丙烯酸的转化率为____________(计算结果保留到小数点后一位)。