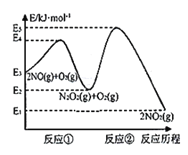
【题目】Ⅰ.宜城市鄂西化工厂以铬铁矿(主要成分为 FeO 和 Cr2O3,含有 Al2O3、SiO2 等杂质)为主要原料生产化工原料红矾钠(主要成分 Na2Cr2O7·2H2O),工艺流程如下图:
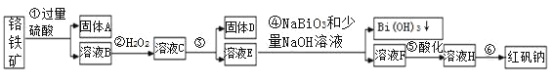
i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为 CrO42-。ii.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
(1)步骤③需加氢氧化钠溶液,此时pH要调到5的目的是__________________。
(2)写出④反应的离子方程式____________________________________。
(3)将溶液 H 经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是______________(填操作名称)。
Ⅱ.经检测鄂西化工厂的工业废水中含 5.00×10-3 mol·L-1 的 Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4(Fe 的化合价依次为+3、+2),又设计了如下工艺流程:
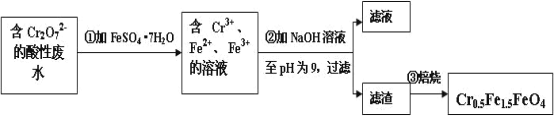
(1)第①步反应的离子方程式是_________________________________________。
(2)欲使 1L 该废水中的 Cr2O72-完全转化为 Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为_________g (已知 FeSO4·7H2O 的摩尔质量为 278 g/mol)。