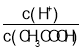【题目】25 ℃时,0.1 mol·L-1HA溶液中 =108,0.01 mol·L-1BOH溶液pH=12。请回答下列问题:
=108,0.01 mol·L-1BOH溶液pH=12。请回答下列问题:
(1)HA的电离常数Ka为________,BOH是________(填“强电解质”或“弱电解质”)。
(2)pH相等的BOH溶液与BA溶液,分别加热到相同的温度后BOH溶液的pH________(填“>”“=”或“<”)BA溶液的pH。
(3)已知碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11,向等浓度的Na2CO3和NaA的溶液中滴加盐酸直至过量,则与H+作用的粒子依次为___________________。
(4)25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=___________________。
②0.10 mol·L-1 NaHSO3溶液中离子浓度由大到小的顺序为_____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________________。