【题目】I.研究金属腐蚀和防腐的原理很有现实意义。
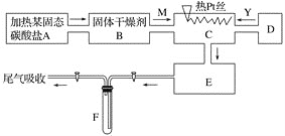
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有______(填序号)。
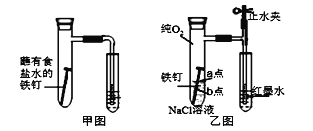
A.用纯氧气代替试管内空气 B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末 D.换成更细的导管,水中滴加红墨水
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐______(填“加快”、“不变”、“减慢”),你认为影响因素为_______。
时间/min | 1 | 3 | 5 | 7 | 9 |
液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
(3)为探究铁钉腐蚀实验 a、b 两点所发生的反应,进行以下实验,请完成表格空白:
实验操作 | 实验现象 | 实验结论 |
向NaCl溶液中滴加2~3滴酚酞指示剂 | a点附近溶液出现红色 | a点电极反应为_____ |
然后再滴加2~3滴铁氰化钾溶液 | b点周围出现蓝色沉淀 | b点电极反应为 Fe -2e-=Fe2+ |
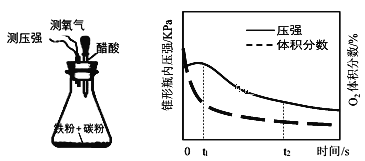
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化见图,从图中可分析,t1~t2之间主要发生_______腐蚀(填吸氧或析氢),原因_______。
(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,试写出该阳极电极反应式______。
II.已知草酸晶体(H2C2O4·XH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为span>0.1000mol/L的KMnO4 标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在______(填“酸式”或“碱式”)滴定管中。
(2)到达滴定终点的标志是________。
(3)根据上述数据计算X=_______。
(4)误差分析(填偏高、偏低或无影响):若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值________;