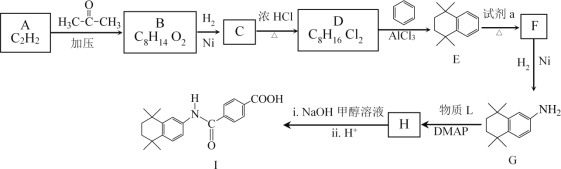
【题目】I.下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
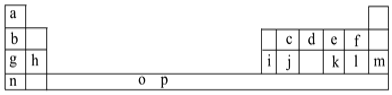
(1)元素p为26号元素,请写出其基态原子电子排布式:___。
(2)d与a反应的产物的分子中中心原子的杂化形式为___,该分子是___(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___。
II.(1)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为__。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为___。S8易溶于二硫化碳的原因是___。
![]()
(2)教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
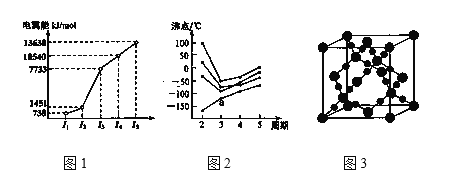
①第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有___种不同运动状态的电子。
②CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于___晶体。
③如图2所示,每条折线表示周期表ⅣA到ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是__。判断依据___。
【题目】某实验小组欲探究醛的银镜反应用银氨溶液而不直接用AgNO3溶液的原因。
(一)甲同学进行了如下对比实验:
装置 | 实验序号 | 试管中的药品 | 现象 |
| 实验Ⅰ | 2%AgNO3溶液1mL,加入2%氨水22滴;再加入3滴新开瓶的40%的乙醛溶液;水浴加热3分钟 | 光亮的银镜 |
实验Ⅱ | 2%AgNO3溶液1mL,加入3滴新开瓶的40%的乙醛溶液;水浴加热3分钟 | 无明显现象 |
(1)乙醛发生银镜反应的化学方程式为_____。
(2)甲同学认为:2%AgNO3溶液应该比用其配制的银氨溶液更易氧化乙醛,可能的理由是_____(写出一条即可);而实验Ⅱ中无明显现象,从化学反应原理的角度解释可能的原因_____(写出一条即可)。
(二)乙同学为了找到银镜反应用银氨溶液的真正原因,先查阅资料,发现醛银镜反应的机理分为如下三步:

(3)据此,乙设计了更好的银镜实验III:2%AgNO3溶液1mL,加入3滴1mol/LNaOH溶液,再加入2%氨水22滴;再加入3滴新开瓶的40%的乙醛溶液;水浴加热,很快出现了银镜。
(4)乙根据实验III并结合反应机理中出现银镜的分步机理(3),得出的结论是_____。
(三)丙同学为了确认AgNO3溶液能氧化醛,继续查找资料,找到了不同浓度的AgNO3溶液对室内HCHO气体去除效果如图。
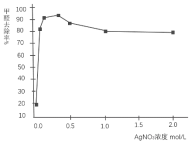
(5)从图中可见:AgNO3溶液浓度达到一定程度,HCHO的去除率基本不变,原因是AgNO3溶液浓度越高,酸性越强,降低了______的还原性;同时,说明了AgNO3溶液和HCHO反应的氧化剂不是______。
(四)结合甲乙丙的实验和资料,丁同学进一步提出,溶液的pH稳定,有利于快速形成均匀光亮的银镜。
(6)请结合化学用语解释AgNO3溶液与乙醛溶液的反应pH变化明显,而银氨溶液变化不明显_____。
(7)综合该实验小组四位同学的实验和论证,最后得出银镜反应用银氨溶液,而不是AgNO3溶液的优点是_____(写出2条即可)。
【题目】X、Y、T、Q、Z 五种元素,位于元素周期表前四周期,元素的性质或结构信息如表:
元素 | 性质或结构信息 |
X | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 |
Y | 基态原子的3p轨道上有4个电子 |
T | 原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 |
Q | 第三周期主族元素中原子半径最小 |
Z | 基态原子的2价阳离子M层轨道全部排满电子 |
请根据上述信息回答下列问题:
(1)写出X3-的一种等电子体的化学式___;
(2)写出T元素基态原子的核外电子排布图___;
(3)元素X、T的电负性相比,___的小(填元素名称);元素X的第一电离能与T相比较,T的___(填“大”或“小”)。
(4)①Z元素在周期表中位于__区。Z单质晶体中Z原子在三维空间里的堆积方式为___堆积。
②Z的氯化物与氨水反应可形成配合物[Z(NH3)4(H2O)2]Cl2,该配合物加热时,首先失去配离中的配体是___(写化学式)。
(5)元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为___,分子中X原子的杂化方式为___杂化。
(6)Y与Z所形成化合物晶体的晶胞如图所示,该化合物的化学式为___。

【题目】水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)],其机制模型如图。
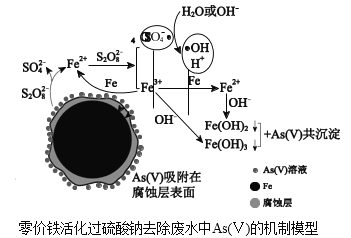
资料:
Ⅰ.酸性条件下SO![]() 为主要的自由基,中性及弱碱性条件下SO
为主要的自由基,中性及弱碱性条件下SO![]() ·和·OH同时存在,强碱性条件下·OH为主要的自由基。
·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe2+ | 7.04 | 9.08 |
Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
①砷在元素周期表中的位置是_____。
②砷酸的化学式是_____,其酸性比H3PO4_____(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O![]() 反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①零价铁与过硫酸钠反应的离子方程式是_____。
②Fe3+转化为Fe2+的离子方程式是_____。
③SO![]() ·和H2O反应的离子方程式是_____。
·和H2O反应的离子方程式是_____。
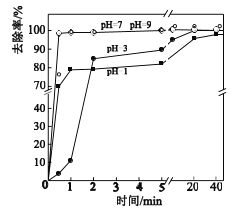
(3)不同pH对As(Ⅴ)去除率的影响如图。5min内pH=7和pH=9时去除率高的原因是_____。
【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3