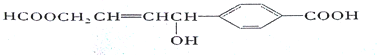【题目】二甲氧基甲烷[CH2(OCH3)2]水溶性好、含氧量高、燃烧完全、烟气排放量低,被认为是一种极具应用前景的柴油添加剂。工业生产CH2(OCH3)2一般是在催化剂作用下,将37%的甲醛(HCHO)水溶液和甲醇(CH3OH)混合共热,反应原理如下:HCHO+2CH3OH![]() CH2(OCH3)2+H2O
CH2(OCH3)2+H2O
(1)某次研究反应时间对产率的影响的实验中,CH2(OCH3)2的浓度随反应时间变化如表:
时间(min) | 20 | 25 | 30 | 40 | 50 | 60 |
CH2(OCH3)2 (mol/L) | 9.02 | 9.10 | 9.18 | 9.23 | 9.30 | 9.32 |
计算25~50min中CH2(OCH3)2的平均生成速率为___。
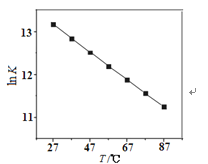
(2)研究反应的化学平衡常数(记作lnK)与温度(T)的关系如图所示,判断该反应的△H___0(填“>”、“<”、“=”)。
(3)假设在密闭容器中发生上述反应:
①达到平衡时下列措施能提高HCHO转化率的是___。
A.及时从反应体系中分离出CH2(OCH3)2
B.升高反应体系的温度
C.再添加适量甲醇
D.再添加一定量甲醛
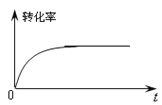
②下图是催化剂作用下甲醇转化率随时间变化的趋势曲线图。请在图中用虚线画出相同条件下,不使用催化剂时转化率随时间变化的曲线。___
(4)进一步研究发现:甲醛的滴加速率、反应时间、催化剂的量和搅拌速率等对CH2(OCH3)2的工业实际产率(不完全是平衡状态下得出的)也会产生一定影响。欲分别研究甲醛的滴加速率、搅拌速率对产率的影响,某同学设计了三组实验如表:
影响因素 实验号 | 甲醛的滴加速率(g/min) | 反应时间(min) | 催化剂的量(g) | 搅拌速率(r/min) |
1 | ___ | 70 | 2.5 | 30 |
2 | 1.0 | ___ | ___ | ___ |
3 | 2.5 | ___ | ___ | 80 |
①请在上表空格中填入剩余的实验条件数据。
②在研究过程中发现,甲醛(HCHO)的滴加速率过慢或过快均会使CH2(OCH3)2产率降低。请结合该反应的合成机理:HCHO![]() HOCH2OCH3
HOCH2OCH3![]() CH2(OCH3)2,试分析甲醛的滴加速率过快时,导致产率较低的原因可能是___。
CH2(OCH3)2,试分析甲醛的滴加速率过快时,导致产率较低的原因可能是___。
【题目】工业合成氨与制备硝酸一般可连续生产,流程如下:
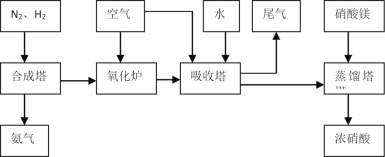
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g)。
CO2(g)+H2(g)。
①t℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=___。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=___。
(2)合成塔中发生反应为:N2(g)+3H2(g)![]() 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___573K(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___573K(填“>”、“<”或“=”)。
T/K | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
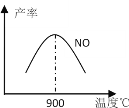
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3+5O2![]() 4NO+6H2O △H=-905kJ·mol-1 ,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因___。
4NO+6H2O △H=-905kJ·mol-1 ,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因___。
(4)吸收塔中反应为:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___。
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:___。