【题目】[化学一选修3:物质结构与性质
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有__________个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是__________,B原子的杂化轨道类型是_____。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_______(填元素符号),判断理由为_______________。
(2)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于____________。

(3)A原子的价电子排布式为3s23p5,铜与A 形成化合物的晶胞如图所示(黑点代表铜原子)。
①该晶体的化学式为______________。
②该化合物难溶于水但易溶于氨水,其原因是_____________ ,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____________。
③己知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,己知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为________pm。
【题目】Ⅰ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g)
2NH3(g)
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(1)则反应物的总能量_________(填“>”或 “<”)生成物的总能量
(2)在一定温度下、向2L密闭容器中加入2 molN2、6 mol H2,在适当的催化剂作用下,发生反应 N2 (g)+3H2 (g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
①下列叙述能说明此反应达到平衡状态的是________________________。
a.容器内总压强不变 b.v(H2)正=v(H2)逆 c.N2和H2的浓度相等
d. 2 mol NH3生成的同时有3 moH—H键断裂 e.NH3的浓度不再改变
②0~10 min内的平均反应速率v(H2) 是______mol/(Lmin);10秒末NH3的浓度是______mol/L;N2 的的物质的量________mol
Ⅱ.某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
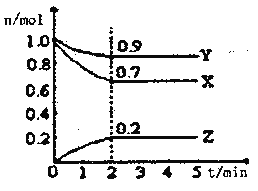
(1)该反应的化学方程式为_______________________
(2)从开始至2min,Z的平均反应速率为____________mol/(L·min);
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度 B.减小物质X的物质的量
C.减小压强 D.增加物质Z的物质的量.
E.加入某种催化剂 F.缩小容积 G.使用效率更高的催化剂
(4)该反应正向为放热反应若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将_________。
a.延长 b.缩短 c.不变 d.无法确定
【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。利用甲醛一定条件下直接脱氢可制甲醛,反应方程式:CH3OH(g)![]() HCHO(g)+H2(g) △H1
HCHO(g)+H2(g) △H1
实验测得随温度升高,平衡常数如下表所示。
温度(K) | 500 | 700 | T1 | T2 | T3 |
平衡常数 | 7.13×10-4 | 3.30×10-1 | 2.00 | 9.00 | 10.00 |
(1)甲醛分子中所有原了都达到稳定结构,甲醛的电子式为_____________。
(2) 若在恒温恒压容器中进行上述反应,可判断反应到达平衡状态的是_______________。
A.混合气体的密度不变
B.CH3OH、HCHO的物质的量浓度之比为1:1
C.H2的体积分数不再改变
D.单位时间内甲醛的生成量与氢气的消耗量相等
(3)T1时,CH3OH、HCHO、H2 起始浓度(mol·L-1)分别为1.0、0.50 、1.0,反应达到平衡时,HCHO 的体积分数___________20% (填“>”、“ =”、“ <”)。
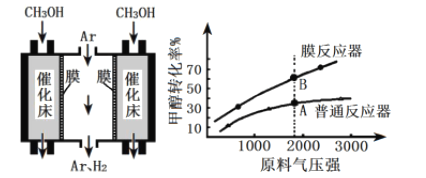
(4)工业上采用膜分离器(对氢气具有很高的选择性和透过率)催化脱氢,装置如下图。为探究转化率变化,分别在普通反应器和膜反应器中,改变原料气压强,控制相同温度,经过相同反应时间,测定甲醇转化率,实验结果如下图。
①A点:v正______v逆(填“>”、“ =”、“ <”),理由是____________;
②B点比A点转化率高的原因是_______________。
(5)体系中加入一定量氧气有利于甲醛的生成。反应体系中存在下列反应:
CH3OH(g)+1/2O2(g)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
H2(g)+12O2(g)![]() H2O(g) △H3
H2O(g) △H3
则△H2、△H3的大小关系是△H2________△H3(填“>”、“ =”、“ <”)。