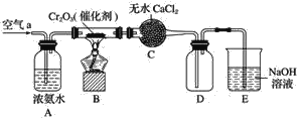
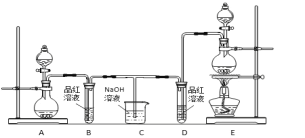
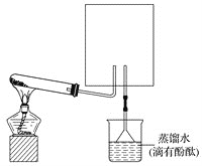
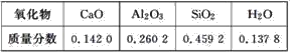
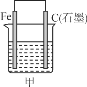
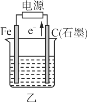
0 198599 198607 198613 198617 198623 198625 198629 198635 198637 198643 198649 198653 198655 198659 198665 198667 198673 198677 198679 198683 198685 198689 198691 198693 198694 198695 198697 198698 198699 198701 198703 198707 198709 198713 198715 198719 198725 198727 198733 198737 198739 198743 198749 198755 198757 198763 198767 198769 198775 198779 198785 198793 203614