【题目】I。草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生反应:
(实验1)甲同学用8.00 mL 0.001 mol/L KMnO4溶液与5.00 mL 0.01 mol/L H2C2O4溶液反应,研究不同条件对化学反应速率的影响。改变的条件如下:
组别 | KMnO4溶液 /mL | H2C2O4溶液 /mL | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL蒸馏水 |
(1)写出草酸(H2C2O4)与高锰酸钾溶液在酸性条件下反应的离子方程式________。
(2)上述进行实验Ⅰ、Ⅲ的目的是探究__________对化学反应速率的影响。
(实验2)乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
(3)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是_______的影响。
(4)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是____(填字母)。
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
Ⅱ.用如图所示的装置进行中和热的测定实验,分别取![]() 的
的![]() 溶液、
溶液、![]() 的硫酸进行实验,回答下列问题:
的硫酸进行实验,回答下列问题:
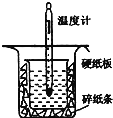
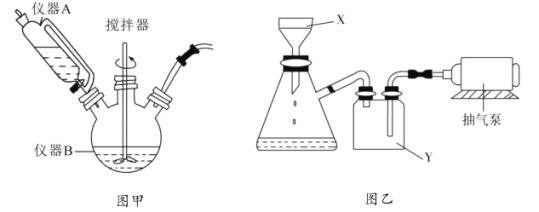
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是__________。
(2)近似认为![]() 的NaOH溶液和
的NaOH溶液和![]() 的硫酸溶液的密度都是
的硫酸溶液的密度都是![]() ,中和后生成溶液的比热容
,中和后生成溶液的比热容![]() ,通过以下数据计算中和热△H=__________(结果保留小数点后一位)。
,通过以下数据计算中和热△H=__________(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)上述实验数值结果与![]() 有偏差,产生偏差的原因可能是(填字母)_____。
有偏差,产生偏差的原因可能是(填字母)_____。
a.实验装置保温、隔热效果差
b.用温度计测定![]() 溶液起始温度后直接测定H2SO4溶液的温度
溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把![]() 溶液倒入盛有硫酸的小烧杯中
溶液倒入盛有硫酸的小烧杯中
d.将以上四实验测量温度均纳入计算平均值