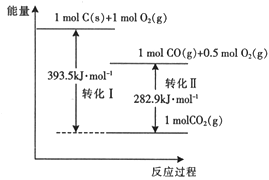
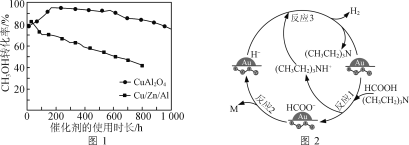
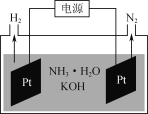
0 198377 198385 198391 198395 198401 198403 198407 198413 198415 198421 198427 198431 198433 198437 198443 198445 198451 198455 198457 198461 198463 198467 198469 198471 198472 198473 198475 198476 198477 198479 198481 198485 198487 198491 198493 198497 198503 198505 198511 198515 198517 198521 198527 198533 198535 198541 198545 198547 198553 198557 198563 198571 203614