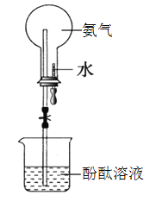
【题目】化学与生活密切相关。
I.K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH(未配平)
(1)基态Cr原子的价电子轨道表达式为__。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为__,碳原子的轨道杂化类型为__,所含σ键与π键的数目之比为__。
(3)已知Cr3+等过渡元素水合离子的颜色如表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为__。
II.ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4)Fe[Zn(OH)Cl2]2溶液中不存在的微粒间作用力有__(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
溶液中[Zn(OH)Cl2]-的结构式为__。
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。
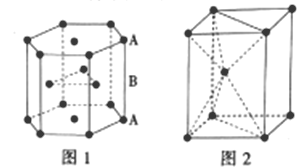
(5)锌的堆积方式为__,配位数为__。
(6)若锌原子的半径为apm,阿伏加德罗常数的值为NA,则锌晶体的密度为___g/cm3(用含a的代数式表示)。
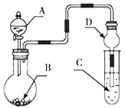
【题目】为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
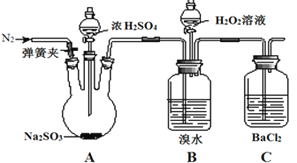
实验操作 | 实验现象 |
i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________。
(2)该实验可以证明SO2具有_________性;H2O2的氧化性_________Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________,B中重新变成红棕色的原因____________________________________(均用离子方程式表示)。
(4)C中产生的白色沉淀是______。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
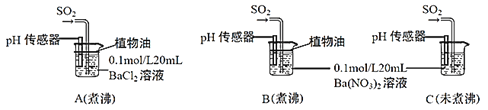
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________。若实验B、C中通入足量的SO2后,溶液酸性:B_________C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________。