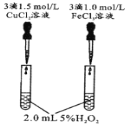
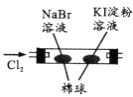
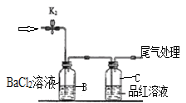
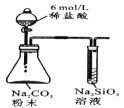
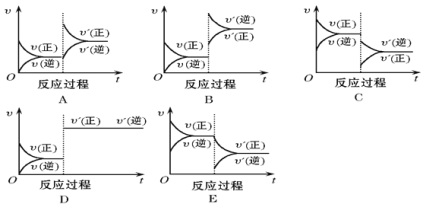
【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | B中产生白色沉淀,C中溶液颜色褪去 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | 硫酸亚铁铵分解的产物中除NH3外还含有SO3 和SO2 | 非金属性:C>Si |
A.AB.BC.CD.D
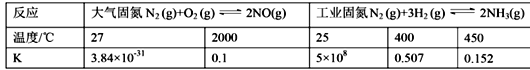
【题目】 H2O2是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂.某化学小组欲探究双氧水的性质做了如下实验:
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用![]() 制取
制取![]() 所需的时间
所需的时间![]() 秒
秒![]()
浓度 时间 反应条件 |
|
|
|
|
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360 | 480 | 540 | 720 |
| 10 | 25 | 60 | 120 |
①研究小组在设计方案时,考虑了浓度、 ______ 、 ______ 因素对过氧化氢分解速率的影响。(2)另一研究小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响,限选试剂与仪器![]() 、
、![]() 、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图1方框内的装置示意图
、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图1方框内的装置示意图![]() 要求所测得的数据能直接体现反应速率大小_________
要求所测得的数据能直接体现反应速率大小_________
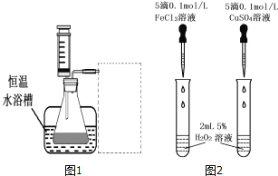
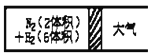
(3)对于H2O2分解反应,![]() 也有一定的催化作用。为比较Fe3+和
也有一定的催化作用。为比较Fe3+和![]() 对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验。请回答相关问题:
对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验。请回答相关问题:
①可通过观察 ____________ ,比较得出结论。
②有同学提出将![]() 的
的![]() 溶液改为
溶液改为![]() 更为合理,其理由是 _________ 。
更为合理,其理由是 _________ 。
(4)已知![]() 溶液中主要含有H2O、Fe3+和Cl-三种微粒,甲同学又做了两种猜想:
溶液中主要含有H2O、Fe3+和Cl-三种微粒,甲同学又做了两种猜想:
猜想1:真正催化分解H2O2的是![]() 溶液中的Fe3+
溶液中的Fe3+
猜想2:真正催化分解H2O2的是 __________________
完成表格,验证猜想:
所需试剂 | 操作及现象 | 结论 |
_________ | __________ | Cl-对H2O2分解无催化作用 |
【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化示意图如图该条件下,1molN2和1molO2完全反应生成NO会吸收______kJ能量。

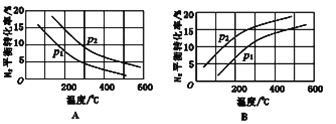
(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.2×10-3 | b | 124 |
Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请表中数据补充完整:a___________;b___________。
②能验证温度对化学反应速率规律的是实验________![]() 填实验序号
填实验序号![]() 。
。
(3)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) |
|
|
|
|
|
|
①用![]() 表示从0-2s内该反应的平均速率
表示从0-2s内该反应的平均速率![]() ______。
______。
②能说明该反应已达到平衡状态的是______
a.单位时间内消耗nmol![]() 的同时,生成2nmol
的同时,生成2nmol![]()
b.容器内各物质的浓度保持不变
c. 2v逆(NO)=v正(O2)
d.混合气体的总物质的量不随时间的变化而变化