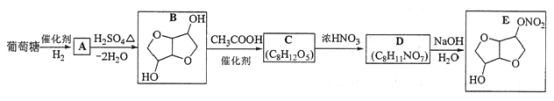
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):
属于电解质的是_______________ ,属于非电解质的是____________________ 。
(2)过量②的水溶液与⑦反应的离子方程式 ________________________________。
(3)已知用金属钠制取氧化钠,可有多种方法:
①4Na + O2=2Na2O; ②4Na + CO2 =2Na2O + C;③2NaNO2 + 6Na =4Na2O + N2↑
在上述三种方法中,最好的是_________ ,原因是___________。
(4)某实验小组通过下列实验探究过氧化钠与水的反应:

①用化学方程式解释使酚酞变红的原因 _______________________________;依据实验现象推测红色褪去的原因是___________________________________。
②加入MnO2反应的化学方程式为 ___________________________________ 。
(5)在实验室模拟侯氏制碱法制备碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。该过程的化学方程式为:____________
(6)在化学课上老师向NaOH溶液通入CO2后无明显现象,那我们如何通过实验证明CO2与NaOH发生了反应?某化学小组同学将过量的干冰放入氢氧化钠溶液中,利用数字化传感器测定溶液pH的变化,如图所示,请用化学方程式回答下列问题:
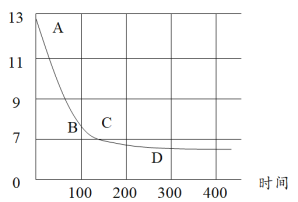
①BC段变化原因可能是 ___________________________________________________________ ;
②CD段变化原因可能是 ___________________________________________________________ 。