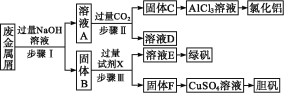
【题目】氯化亚铁常用于检测硒、污水处理等,其制备和元素含量测定方法有多种。 请回答下列问题:
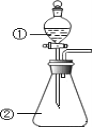
(1)方法一:用H2还原无水FeCl3制备, 已知FeCl2、 FeCl3易吸水。实验所需装置如下:

按气流从左到右的方向,装置的连接顺序为_________(仪器可重复使用)。
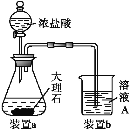
(2)方法二:用如图装置(夹持装置省略)制备氯化亚铁,发生反应2FeCl3+C6H6Cl→ 2FeCl2+C6H4Cl2+HCl。向A中加入无水氯化铁和氯苯,控制反应温度在一定范围加热一段时间。

相关物质的部分物理性质如表:
C6H5Cl(氯苯) | 对二氯苯 | 邻二氯苯 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | |||
熔点/℃ | -45 | 53 | -15 | — | — |
沸点/℃ | 132 | 173 | 180.5 | — | — |
①仪器B的名称是_________; 反应的温度最好控制在______左右:反应结束后,冷却实验装置,将仪器A内物质经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂是________。
②通过烧杯中的现象变化可监测反应的转化率,则烧杯C中所加试剂是_______。
③过滤液中含氯苯、邻二氯苯和对二氯苯,下列方法可用于鉴别氯苯和对二氯苯的是________。
a.质谱法 b.核磁共振氢谱法 c.元素分析法
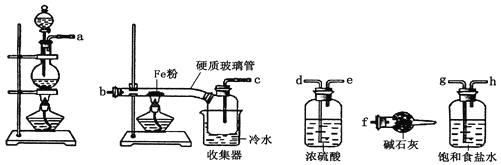
(3)某同学用滴定法测定产品中铁元素含量,其测定过程如图:

①该过程中酸溶时选择的最佳试剂是____;还原剂是_______。
②若滴定过程中消耗c mol·L-1KMnO4溶液VmL,则样品中铁元素的质量分数是_____。 (用含a、c、V的代数式表示)