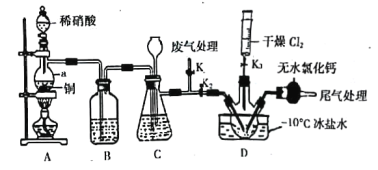
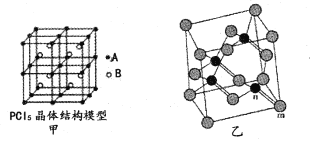
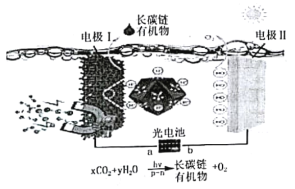
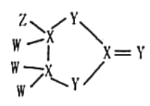
0 197271 197279 197285 197289 197295 197297 197301 197307 197309 197315 197321 197325 197327 197331 197337 197339 197345 197349 197351 197355 197357 197361 197363 197365 197366 197367 197369 197370 197371 197373 197375 197379 197381 197385 197387 197391 197397 197399 197405 197409 197411 197415 197421 197427 197429 197435 197439 197441 197447 197451 197457 197465 203614