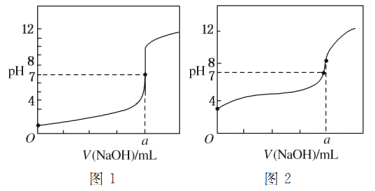
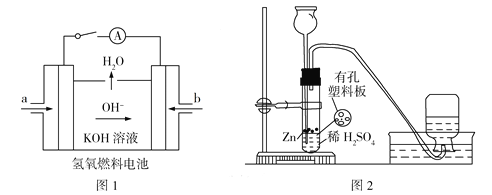
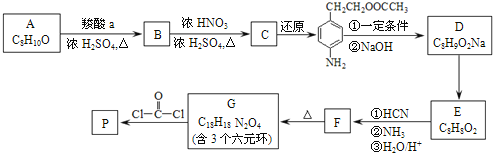
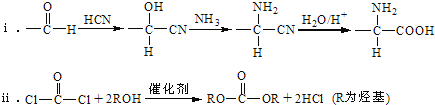
【题目】硫和锌及其化合物用途广泛。回答下列问题:
(1)基态硫原子的价电子排布图为__________________。
(2)已知基态锌、铜的电离能如表所示:
电离能/kJ·mol1 | I1 | I2 |
Cu | 746 | 1958 |
Zn | 906 | 1733 |
由表格数据知,I2(Cu)>I2(Zn)的原因是____________________________________。
(3)H2O分子中的键长比H2S中的键长__________(填“长”或“短”)。H2O分子的键角比H2S的键角大,其原因是____________________________________。
(4)S8与热的浓NaOH溶液反应的产物之一为Na2S3,S32-的空间构型为__________________。
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ,则噻吩分子中的大π键应表示为______________。
,则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84 ℃,吡咯(![]() )的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
)的沸点在129~131 ℃之间,后者沸点较高,其原因是____________________________。1 mol吡咯含__________mol σ键。
(6)硫化锌是一种半导体材料,其晶胞结构如图所示。
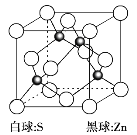
已知:硫化锌晶体密度为d g·cm-3,NA代表阿伏加德罗常数的值,则Zn2+和S2-之间的最短核间距(x)为__________nm(用代数式表示)。
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如图:
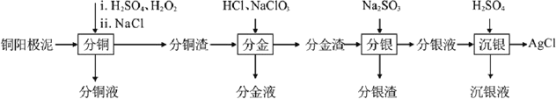
已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-
Ag++2SO32-
ⅲ“分铜”时各元素的浸出率如下表所示。
Cu | Au | Ag | Ni | |
浸出率/% | 85.7 | 0 | 4.5 | 93.5 |
(1)由表中数据可知,Ni的金属性比Cu____。分铜渣中银元素的存在形式为_________(用化学用语表示)。
(2)“分金”时,单质金发生反应的离子方程式为____。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。
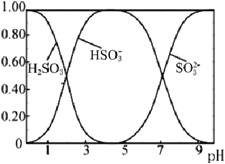
“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为__。调节溶液的pH不能过低,理由为__(用离子方程式表示)。
(4)工业上,用镍为阳极,电解0.1mol/LNiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
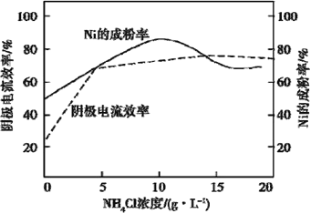
为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_____g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_____。