【题目】某研究小组查阅资料发现Fe3+与I-的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在Fe3+,并据此设计实验1(如下图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
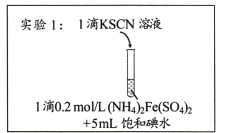
I.初步探究
实验2:用煮沸冷却后的蒸馏水重新配制两种饱和溶液进行实验,实验记录如下表。
编号 | 饱 和 (NH4)2Fe(SO4)2溶液 | 饱和碘水 | 石蜡油 | 操作 | KSCN溶液 | 现象 |
2-1 | 1滴 | 5mL | 1mL | 不加热 | 1滴 | 无明显现象 |
2-2 | 1滴 | 5mL | 1mL | 加热一段时间后冷却 | 1滴 | 无明显现象 |
(1)研究小组同学根据所查阅资料写出的Fe3+与I-反应的离子方程式为____。
(2)实验2中,加入石蜡油的目的是____。
(3)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是___。
II.查阅资料,继续探究
(资料)AgSCN为不溶于水的白色固体。
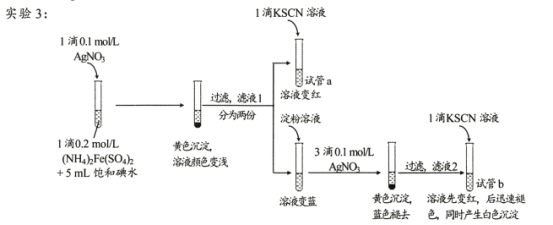
(4)试管a的实验现象说明滤液l中含有____。
(5)试管b中,加入KSCN溶液后所产生实验现象的原因是 ___。
(6)甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。他提出如下假设:i.可能是AgNO3氧化了Fe2+;ii.可能是空气中的O2氧化了Fe2+。 他设计、实施了实验4,实验记录如下表。
编号 | 实验操作 | 实验现象 |
4 | 在试管中加入1滴0.2mol/L(NH4)2Fe(SO4)2溶液,5mL蒸馏水,1滴试剂a,一段时间后加入1滴KSCN溶液 | 溶液不变红 |
①试剂a是 ___。
②依据实验4,甲同学做出判断:______________________
(7)根据实验1~4所得结论是____。