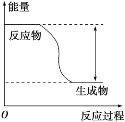
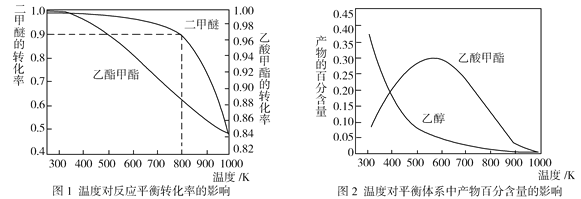
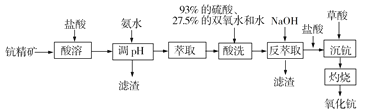
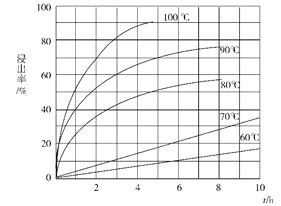
【题目】下表是元素周期表的一部分,请用化学用语回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)⑥的氢氧化物中,所含化学键的类型是______。
(2)①和④可形成化合物,用电子式表示其形成过程______。
(3)⑦的最高价氧化物的水化物与⑧的最高价氧化物的水化物反应的离子方程式为_____。
(4)研究物质的性质差异性是学习的重要方法之一。②、③、⑧、⑨四种元素的最高价氧化物的水化物中,化学性质明显不同于其它三种酸的是______。
(5)能说明元素⑤的非金属性强于元素⑨的非金属性的实验事实是_____(填字母)。
A.两种单质的熔沸点不同
B.两种单质与氢气化合的难易程度
C.比较这两种元素的最高价氧化物的水化物的酸性
【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30mL1.0molL-1H3PO4和3mL30%H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30mL1.0molL-1H3PO4和3mLH2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85%H3PO4配制100mL1.0mol·L-1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)请结合实验Ⅱ中现象,分析铁钉与H3PO4反应的产物_______。
(3)探究实验Ⅰ中停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是未排除O2的干扰,请解释O2是如何干扰实验的:_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。形成氧化膜(以Fe3O4计)的离子方程式是____。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率角度分析其原因:______。
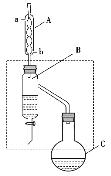
【题目】乙酸丁酯是重要的化工原料。实验室用乙酸、丁醇在浓硫酸作催化剂、加热条件下制备乙酸丁酯的装置示意图(加热和夹持装置已省略)和有关信息如下:
乙酸 | 正丁醇 | 乙酸丁酯 | |
熔点/℃ | 16.6 | -89.5 | -73.5 |
沸点/℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
下列说法正确的是( )
A.加热一段时间后,发现烧瓶C中忘记加沸石,可打开瓶塞直接加入即可
B.装置B的作用是不断分离出乙酸丁酯,提高产率
C.装置A可以装配蒸馏装置的冷凝器,且冷凝水由a口进,b口出
D.乙酸丁酯中残留的乙酸和正丁醇可用饱和碳酸钠溶液除去