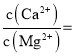【题目】有四种短周期元素,相关信息如下表。
元素 | 相关信息 |
A | 气态氢化物极易溶于水,可用作制冷剂 |
B | 单质的焰色反应为黄色 |
C | 单质是黄绿色气体,可用于自来水消毒 |
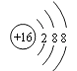
D | –2价阴离子的结构示意图是 |
请根据表中信息回答:
(1) A在周期表中的位置______。
(2) B与C形成化合物的类型为______(填“离子化合物”或“共价化合物”)
(3) 最高价氧化物对应的水化物的酸性C强于D,请用原子结构解释原因______。
(4) 已知硒(Se) 与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是______。
a.非金属性比D元素的强
b.SeO2既有氧化性又有还原性
c.最高价氧化物对应的水化物的化学式为H2SeO4
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用![]() 等作为催化剂,采用如下反应来合成甲醇:
等作为催化剂,采用如下反应来合成甲醇:![]()
(1)下表是有关化学键的键能数据,计算表中的a=__________。
化学键 |
|
|
|
|
|
键能 | 436 | 462.8 | a | 1075 | 351 |
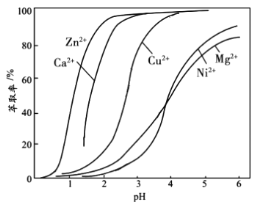
(2)将![]() 的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中
的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中![]() 的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
(3)某学习小组模拟工业合成甲醇的反应,在![]() 的恒容密闭容器内充入
的恒容密闭容器内充入![]() 和
和![]() ,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
从反应开始到![]() 时,
时,![]() 的平均反应速率为______,该温度下的平衡常数
的平均反应速率为______,该温度下的平衡常数![]() 为______。
为______。
(4)另将![]() 和
和![]() 加入密闭容器中,在一定条件下发生上述反应。平衡时
加入密闭容器中,在一定条件下发生上述反应。平衡时![]() 的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
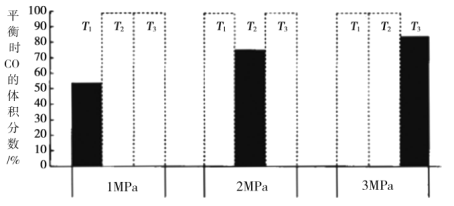
![]() 由大到小的关系是__________,判断理由是__________。
由大到小的关系是__________,判断理由是__________。
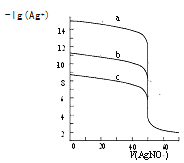
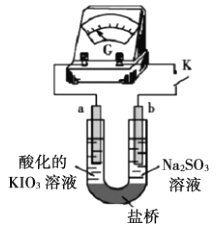
【题目】某小组探究![]() 溶液和
溶液和![]() 溶液的反应原理。
溶液的反应原理。
(实验一)将含淀粉的![]() 溶液加入
溶液加入![]() 酸性溶液(过量)中,混合后约5秒内无明显变化,随后有少量蓝色出现并迅速变蓝。
酸性溶液(过量)中,混合后约5秒内无明显变化,随后有少量蓝色出现并迅速变蓝。
(1)溶液变蓝,说明![]() 具有__________性。
具有__________性。
(2)查阅文献:
反应Ⅰ:![]() 慢
慢
反应Ⅱ:![]() _____=_____+_____ 较快
_____=_____+_____ 较快
反应Ⅲ:![]() 快
快
写出酸性条件下,反应Ⅱ的离子方程式__________。
(3)向实验一所得蓝色溶液中加入少量![]() 溶液,蓝色迅速褪去,后又变蓝色。据此得出
溶液,蓝色迅速褪去,后又变蓝色。据此得出![]() 氧化性比
氧化性比![]() 强,该结论______(填“合理”或“不合理”),理由是_________。
强,该结论______(填“合理”或“不合理”),理由是_________。
(4)为了进一步研究![]() 溶液和
溶液和![]() 溶液的反应原理,设计如下实验。
溶液的反应原理,设计如下实验。
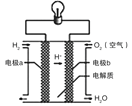
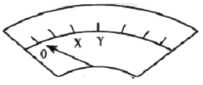
(实验二)装置如图所示,![]() 闭合后,电流表的指针偏转情况记录如表:
闭合后,电流表的指针偏转情况记录如表:
表盘 |
|
| ||
时间/min |
|
|
| |
偏转位置 | 右偏至“Y”处 | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针归零 | |
①![]() 闭合后,检验b极附近溶液存在放电产物
闭合后,检验b极附近溶液存在放电产物![]() 的实验操作是__________。
的实验操作是__________。
②![]() 时,直接向a极区滴加淀粉溶液,溶液未变蓝。取a极附近溶液于试管中,滴加淀粉溶液,溶液变蓝。判断
时,直接向a极区滴加淀粉溶液,溶液未变蓝。取a极附近溶液于试管中,滴加淀粉溶液,溶液变蓝。判断![]() 在a极放电的产物是__________。
在a极放电的产物是__________。
(5)下列关于上述实验解释合理的是__________(填字母序号)。
A.实验一中:5秒内无明显变化,可能是因为反应Ⅰ的活化能太小,反应速率太慢
B.实验二中:指针回到“0”处,可能是因为反应Ⅱ比反应Ⅰ快,导致![]() 难与
难与![]() 发生反应
发生反应
C.实验二中:又返至“X”处,可能是因为发生了反应Ⅲ,重新形成了原电池