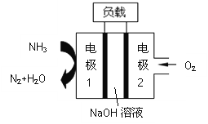
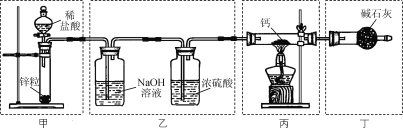
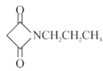
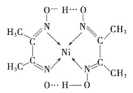
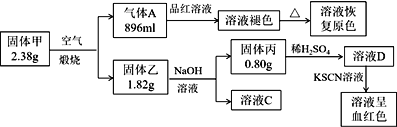
【题目】Ⅰ.为了探究一种固体化合物甲(仅含3种元素)的组成和性质,设计并完成如下实验:(气体体积已经换算成标准状况下的体积)
请回答:
(1)写出化合物甲的化学式________。
(2)写出形成溶液C的化学方程式:_____________。
(3)写出气体A通入溶液D中,发生反应的离子反应方程式__________。
Ⅱ.近年来化学家又研究开发出了用 H2和CH3COOH 为原料合成乙醇(反应Ⅰ),同时会发生副反应Ⅱ。
反应Ⅰ.CH3COOH(g)+2H2(g)![]() CH3CH2OH(g) +H2O(g) △H1
CH3CH2OH(g) +H2O(g) △H1
反应Ⅱ. CH3COOH(g)+H2(g)![]() CO(g)+CH4(g)+H2O(g) △H2>0
CO(g)+CH4(g)+H2O(g) △H2>0
已知:乙醇选择性是转化的乙酸中生成乙醇的百分比。请回答:
(1)反应Ⅰ一定条件下能自发进行,则△H1 ___0。(填“>”或“<”)
(2)某实验中控制 CH3COOH 和 H2 初始投料比为 1∶1.5,在相同压强下,经过相同反应时间测得如下实验数据:
温度(K) | 催化剂 | 乙酸的转化率(%) | 乙醇选择性(%) |
573 | 甲 | 40 | 50 |
573 | 乙 | 30 | 60 |
673 | 甲 | 55 | 35 |
673 | 乙 | 40 | 50 |
①有利于提高CH3COOH转化为CH3 CH2OH平衡转化率的措施有______。
A 使用催化剂甲 B 使用催化剂乙
C 降低反应温度 D 投料比不变,增加反应物的浓度
E 增大CH3COOH和H2的初始投料比
②673K甲催化剂作用下反应Ⅰ已达平衡状态,测得乙酸的转化率为50%,乙醇的选择性40%,若此时容器体积为 1.0L,CH3COOH 初始加入量为2.0mol,则反应Ⅰ的平衡常数 K= _____。
③表中实验数据表明,在相同温度下不同的催化剂对CH3COOH转化成CH3CH2OH的选择性有显著的影响,其原因是_________________。
(3)在图中分别画出I在催化剂甲和催化剂乙两种情况下“反应过程-能量”示意图。_____

【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式__________
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称"同系物"),它们均符合通式CnH2n+2。当n=______时,这类有机物开始出现同分异构体。
(3)B具有的性质是__________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式__________
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为____;其化学方程式为__________
【题目】汽车排放的尾气为大气污染物之一,目前,可利用以下化学原理处理汽车尾气:2NO+2CO![]() 2CO2+N2。
2CO2+N2。
(1)写出CO2的结构式____________。
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
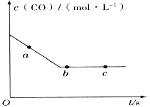
则反应速率v(a)、v(b)、v(c)的大小关系是_______。
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
(资料查阅)A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响。
(实验设计)课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验:
实验编号 | 实验目的 | T/℃ | NO初始浓度/(mol/L) | CO初始浓度/(mol/L) | 同种催化剂的比表面积/(m2/g) | c(CO)不变时所用的时间/min |
Ⅰ | 参照实验 | 280 | 6.50×10-5 | 4.00×10-3 | 80 | t |
Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
Ⅲ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
(结论)
① 实验编号Ⅱ的实验目的为______________。
② 课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是_______, 且______反应速率将_______(填“增大”“减小”或“无影响”)。