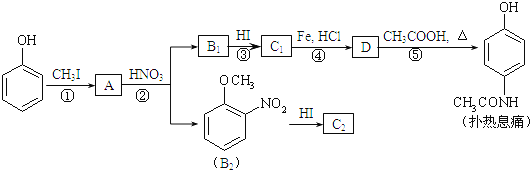
【题目】雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH=________________。
(2)为减少SO2的排放,常将煤转化为清洁气体燃料:
已知:H2(g)+ ![]() O2(g) =H2O(g) △H= -241.8kJ·mol-1
O2(g) =H2O(g) △H= -241.8kJ·mol-1
C(s)+ ![]() O2(g) =CO(g) △H = -110.5kJ·mol-1
O2(g) =CO(g) △H = -110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:_________________________________________________。
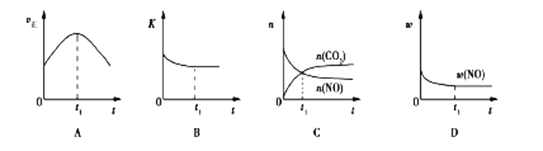
(3)汽车尾气净化的主要原理:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g); △H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g); △H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式______________________;
②计算上述反应T1℃时的平衡常数K1=______________________;若T1<T2,则该反应的△H _____0(填“>”、“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;
【题目】NiOOH难溶于水,常作电池的正极材料。利用某含镍废料(主要成分为NiO,另含有SiO2、Fe2O3、CuO三种杂质)制备NiOOH的工业流程如图。
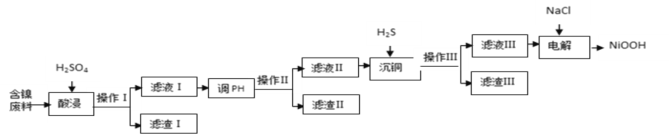
已知:
Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | |
开始沉淀的pH | 1.5 | 4.4 | 6.7 |
沉淀完全的pH | 3.7 | 6.9 | 9.2 |
(1)提高酸浸速度的方法为_______________________、_____________________(任写2条)
(2)滤渣Ⅰ的成分为__________;若滤渣Ⅱ为Fe(OH)3,则“调pH”的范围为_____________.
(3)沉铜时发生反应的离子方程式为______________________________________________。
(4)电解过程是控制在碱性条件下阳极产生ClO-,并用ClO-将Ni2+氧化的过程。请写出氧化过程中发生反应的离子方程式____________________________________________________。