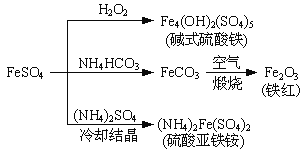
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
【题目】化学与社会、生活密切相关,对下列现象或事实的解释正确的是( )
现象或事实 | 解释 | |
A | 用热的纯碱溶液去油污 | Na2CO3可直接与油污反应 |
B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
C | 施肥时,草木灰(主要成分K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl在潮湿的土壤中会反应生成氨气,降低肥效 |
D | FeCl3溶液可用于铜质印刷线路板制作 | Cu能从FeCl3溶液中把铁还原为游离态 |
A.AB.BC.CD.D
【题目】已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
回答下列问题:
(1)该反应的平衡常数表达式K= ______ ,△H= ______ 0(填“<”“>”“=”);
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05molL-1.则A的平均反应速率v(A)= ______ .该反应达到平衡时A的转化率为 ______ ,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为 ______ (填”变大“、”变小“或”不变“)
(3)判断反应是否达到平衡的依据为 ______ (填字母代号).
a 压强不随时间改变 b 气体的密度不随时间改变
c c(A)不随时问改变 d 单位时间里生成C和D的物质的量相等
(4)1200℃时,若向另一相同容器中充入0.30molA、0.40mol B、0.40mol C和0.50molD,此时v正 ______ v逆(填”大于“、”小于“或”等于“).
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有含有SO2和NOx的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表》
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“提高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
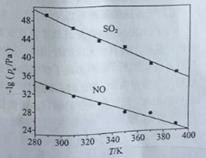
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的有点是_______。
②已知下列反应:
SO2(g)+2OH(aq) ===SO32(aq)+H2O(l) ΔH1
ClO(aq)+SO32(aq) ===SO42(aq)+Cl(aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO(aq) +2OH(aq) ="==" CaSO4(s) +H2O(l) +Cl(aq)的ΔH=______。