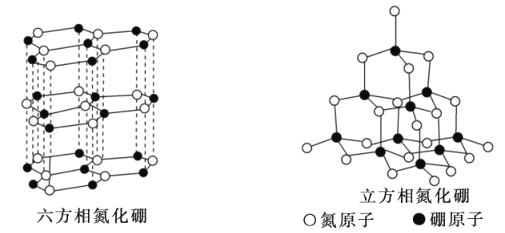
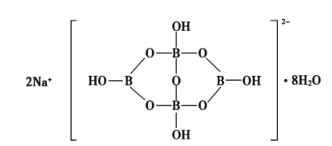
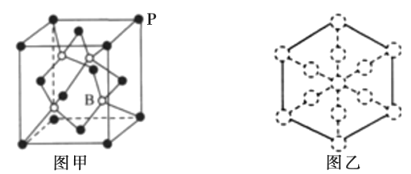
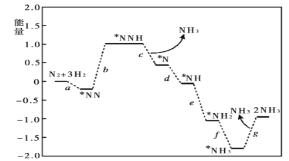
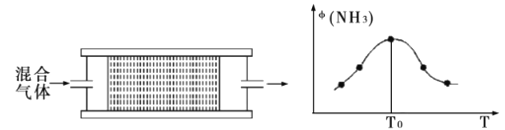
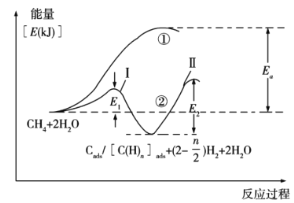
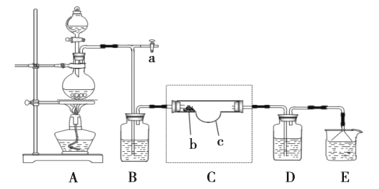
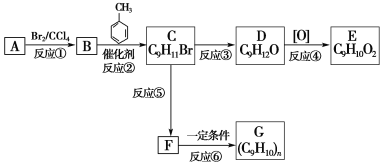
0 196791 196799 196805 196809 196815 196817 196821 196827 196829 196835 196841 196845 196847 196851 196857 196859 196865 196869 196871 196875 196877 196881 196883 196885 196886 196887 196889 196890 196891 196893 196895 196899 196901 196905 196907 196911 196917 196919 196925 196929 196931 196935 196941 196947 196949 196955 196959 196961 196967 196971 196977 196985 203614