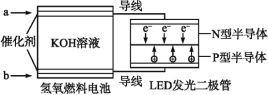
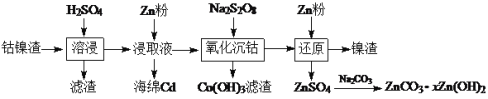
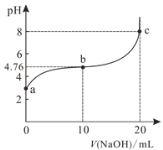
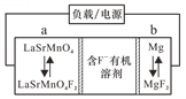
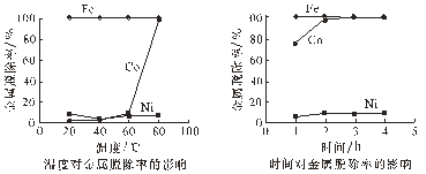【题目】在古代,橘红色的铅丹(Pb3O4)用于入药和炼丹,人们对其中重金属铅的毒性认识不足。已知:PbO2为棕黑色粉末。某化学兴趣小组对铅丹的一些性质进行实验探究并测定其组成。
回答下列问题:
(1)性质实验
实验操作 | 现象 | 解释或结论 |
①将适量铅丹样品放入小烧杯中,加入2mL6mol/L的HNO3溶液,搅拌 | _____ | Pb3O4+4HNO3=PbO2+ 2Pb(NO3)2+2H2O |
②将上述混合物过滤,所得滤渣分为两份,一份加入2mL浓盐酸,加热 | 有刺激性的黄绿色气体产生 | 反应的化学方程式: _______ |
③另一份滤渣加入硝酸酸化的Mn(NO3)2溶液,搅拌 | 得紫色溶液 | 结论:_______ |
(2)组成测定
①准确称取0.530g干燥的铅丹样品,置于洁净的小烧杯中,加入2mL6mol/L的HNO3溶液,搅拌使之充分反应,分离出固体和溶液。该分离操作名称是_____________。
②将①中所得溶液全部转入锥形瓶中,加入指示剂和缓冲溶液,用0.04000mol/L的EDTA溶液(显酸性)滴定至终点,消耗EDTA溶液36.50mL。EDTA与Pb2+的反应可表示为Pb2++H2Y2-=PbY2-+2H+,滴定时EDTA溶液应盛装在_______________中。滤液中含Pb2+__________mol。
③将①中所得固体PbO2全部转入另一锥形瓶中,往其中加入适量HAc与NaAc的混合液和8g固体 KI,摇动锥形瓶,使PbO2全部反应而溶解,发生反应PbO2+4I-+4HAc =PbI2+I2+4Ac-+2H2O,此时溶液呈透明棕色。以0.05000mol/L的Na2S2O3标准溶液滴定,发生反应I2+2S2O32-=S4O62-+2I-,至溶液呈淡黄色时加入2%淀粉溶液1mL,继续滴定至溶液_______,即为终点,用去Na2S2O3溶液30.80mL。
根据②、③实验数据计算,铅丹中Pb(Ⅱ)与Pb(Ⅳ)的原子数之比为____________。
【题目】[化学——选修3:物质结构与性质]
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(KJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
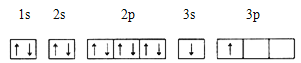
①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背 ,B元素位于周期表五个区域中的 区。
②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为 。
②写出一种与CN-互为等电子体的单质的电子式 。
③六氰合亚铁离子[Fe(CN)6]4-中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
(3)一种Al-Fe合金的立体晶胞如右图所示。请据此回答下列问题:
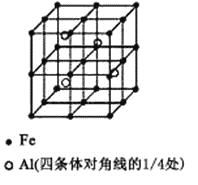
①确定该合金的化学式 。
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。