【题目】自从1902年德国化学家哈伯研究出合成氨的方法以来,氮的固定的相关研究获得了不断的发展。
(1)下表列举了不同温度下大气固氮的部分平衡常数K值。
反应 | 大气固氮N2(g)+O2(g) | |
温度/℃ | 27 | 2260 |
K | 3.84×10-31 | 1 |
①分析数据可知:大气固氮反应属于______(填“吸热”或“放热”)反应。
②2260℃时,向2 L密闭容器中充入0.3mol N2和0.3mol O2,20 s时反应达平衡。则此 时得到NO____mol,用N2表示的平均反应速率为____。
(2)已知工业固氮反应:N2(g)+3H2(g) ![]() 2NH3 (g) △H<0,在其他条件相同时,分别测定此反应中N2的平衡转化率随压强和温度(T)变化的曲线如下图A、B所示,其中 正确的是_____(填“A”或“B”),T1______T2(填“>”或“<”)。
2NH3 (g) △H<0,在其他条件相同时,分别测定此反应中N2的平衡转化率随压强和温度(T)变化的曲线如下图A、B所示,其中 正确的是_____(填“A”或“B”),T1______T2(填“>”或“<”)。
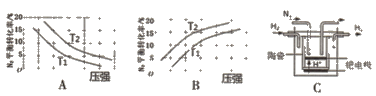
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它 内外表面上的金属钯多晶薄膜做电极,通过电解实现高温常压下的电化学合成氨。其示意图如C所示,阴极的电极反应式为______。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3 (aq) +3O2(g) △H。
4NH3 (aq) +3O2(g) △H。
已知:①N2(g)+3H2(g) ![]() 2NH3(g) △H1
2NH3(g) △H1
②2H2(g) +O2(g) ![]() 2H2O(1) △H2
2H2O(1) △H2
③NH3(g) ![]() NH3(aq) △H3
NH3(aq) △H3
则△H= ________(用含△H1、△H2、△H3的式子表示)。