【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g)△H=+183kJ/mol,2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol,4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=﹣1164.4kJ/mol,则N2(g)+3H2(g)
2NO(g)△H=+183kJ/mol,2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol,4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=﹣1164.4kJ/mol,则N2(g)+3H2(g)![]() 2NH3(g)△H=____________ ;
2NH3(g)△H=____________ ;
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0mol/L | 3.0mol/L | 0 |
投料Ⅱ | 1.0mol/L | 2mol/L | 1.0mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡时化学平衡常数为0.1,则该温度下合成氨反应的平衡常数表达式为_____;
②按投料Ⅱ进行反应,起始时反应进行的方向为_____________(填“正向”或“逆向”);
③若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是____;
a.NH3是N2浓度的2倍b.容器中气体的压强不再改变c.2v(NH3)正=v(N2)逆d.容器中混合气体的密度不再改变e.容器中N2、H2、NH3物质的量之比为1:3:2f.混合气体平均相对分子质量保持不变
④若升高温度,则合成氨反应的化学平衡常数_______(填“变大”、“变小”或“不变”);
⑤L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系;
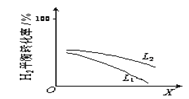
ⅰ)X代表的物理量是_________________;
ⅱ)判断L1、L2的大小关系,L1__________L2.(填“>”“<”或“=”)
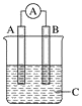
⑶电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意如图:
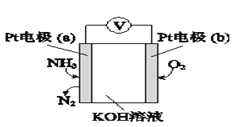
①电极b上发生的是____________反应(填“氧化”或“还原”)。
②写出电极a的电极反应式:________________________。
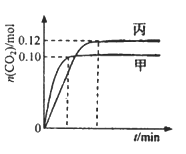
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
N2(g)+2CO2(g),各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
容器 | 温度/℃ | 起始物质的量浓度/mol·L-1 | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T1 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 乙容器中反应达到平衡时,N2的转化率大于40%
C. 达到平衡时,乙容器中的压强一定大于甲容器的2倍
D. 丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,此时v(正)>v(逆)