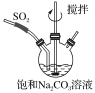
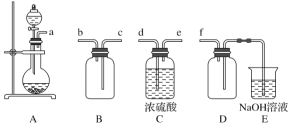
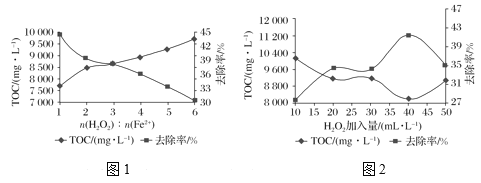
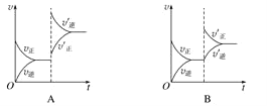
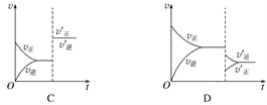
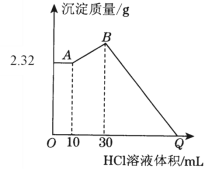
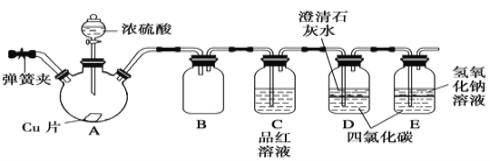
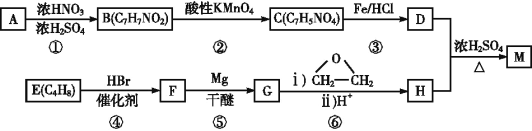
0 196651 196659 196665 196669 196675 196677 196681 196687 196689 196695 196701 196705 196707 196711 196717 196719 196725 196729 196731 196735 196737 196741 196743 196745 196746 196747 196749 196750 196751 196753 196755 196759 196761 196765 196767 196771 196777 196779 196785 196789 196791 196795 196801 196807 196809 196815 196819 196821 196827 196831 196837 196845 203614