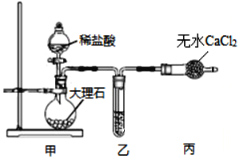
【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2 (亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目:___。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+ 而中毒,可服用维生素C 解毒。下列分析错误的是__(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是___(填序号)。
A.焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___。
【题目】一定量的Na2CO3和NaHCO3的均匀混合物分成质量不等的三份,分别与50mL相同浓度的盐酸反应,得到气体的质量与固体混合物的质量关系如下表所示:
组 别 | 1 | 2 | 3 |
固体质量/g | 3.80 | 6.20 | 7.20 |
气体质量/g | 1.76 | 2.64 | 2.64 |
(1)上表中_______组数据表明盐酸参加反应后有剩余,理由是______________。
(2)上表中第2组数据中盐酸____________(填“过量”、“适量”、“不足量”)。
(3)通过计算求Na2CO3和NaHCO3的质量分数各为_________、____________。