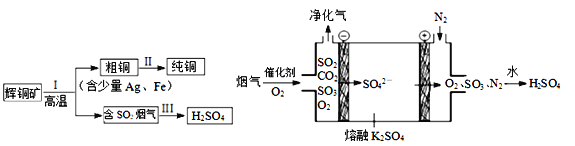
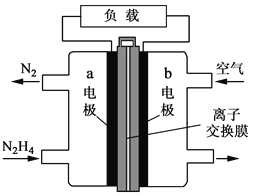
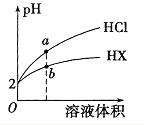
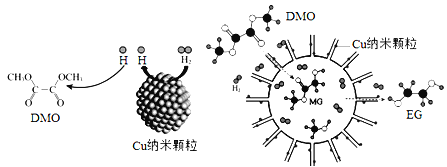
【题目】(1)如图进行实验,将a溶液逐渐加入盛b溶液的试管中,写出试管中观察到的现象及对应的离子方程式。
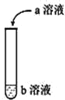
a | b | 试管中现象 | 离子方程式 |
Na2CO3 | 稀盐酸 | ________________ | _________ |
稀盐酸 | Na2CO3 | ______________ | _______________ |
(2)工业上利用NaIO3和NaHSO3反应来制取单质I2。配平下列化学方程式并用单线桥法表示电子转移的方向和数目:
_____NaIO3+_____NaHSO3=_____I2+_____Na2SO4+_____H2SO4+_____H2O
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取![]() 。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目_____________________。
。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目_____________________。
【题目】甲醇是一种新型的汽车动力燃料。请回答下列问题:
(1)工业上可通过CO和H2化合来制备CH3OH(g)。已知某些化学键的键能数据如下表:
化学键 | C-C | C-H | H-H | C-O |
| H-O |
键能/kJmol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知:CO中的C与O之间形成的化学键为![]() 键。工业制备甲醇的热化学方程式__________________;
键。工业制备甲醇的热化学方程式__________________;
(2)在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适的催化剂(体积可以忽略不计)后,在250℃下开始反应,并用压力计检测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 10.8 | 9.6 | 8.4 | 7.8 | 7.2 | 7.2 |
则从反应开始到20min时,以CO表示的平均反应速率为___________,该温度下平衡常数K= ______;若升高温度,则CO的转化率_______(填“增大”“减小”或“不变”);
(3)在三个容积均为1 L的恒容密闭容器中只发生反应:2CH3OH(g) ![]() C2H4(g)+2H2O(g),依据表中的相关数据可确定该反应的ΔH______0(填“>”“<”或“=”,下同);容器C达到平衡时,容器中总压强p(C)/p(A)_______2;容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,此时,υ(正)_______υ(逆)。
C2H4(g)+2H2O(g),依据表中的相关数据可确定该反应的ΔH______0(填“>”“<”或“=”,下同);容器C达到平衡时,容器中总压强p(C)/p(A)_______2;容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H2O(g)各0.1 mol,此时,υ(正)_______υ(逆)。
容器 | 温度/℃ | 起始加入量/mol | 平衡时乙烯/mol | ||
CH3OH(g) | C2H4(g) | H2O(g) | |||
A | 310 | 0.2 | 0 | 0 | 0.05 |
B | 327 | 0 | 0.1 | 0.2 | 0.047 |
C | 310 | 0.2 | 0.1 | 0.2 | / |