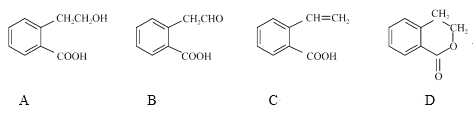
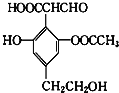
【题目】某化学小组以苯甲酸和异丙醇为原料,制取苯甲酸异丙酯(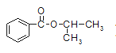 )。
)。
已知有关物质的沸点如下表:
物质 | 异丙醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 82.4 | 249 | 218 |
Ⅰ.合成苯甲酸异丙酯粗产品:
在如图的三颈烧瓶加入12.2g苯甲酸和30mL异丙醇(密度约为0.79g/cm3),再小心加入3mL浓硫酸,混匀后,加入几块碎瓷片,维持温度85-90℃,加热30分钟,使反应充分,得苯甲酸异丙酯粗产品。
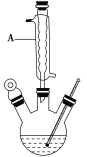
(1)仪器A的名称是_______,加入碎瓷片的作用是_______。
(2)制备苯甲酸异丙酯的化学方程式是______。
(3)合成过程中最适合的加热方式是____。
A.酒精灯直接加热 B.油浴
C.水浴 D.砂浴
Ⅱ.粗产品的精制:
(4)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,现拟用下列流程图进行精制,操作①中用到的一种重要玻璃仪器是_______;操作②的名称是_____。
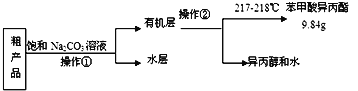
(5)结合上述相关数据进行计算,苯甲酸异丙酯的产率为______%。
【题目】某实验小组为了探究铝与盐酸反应过程中的速率变化,分两组做了以下实验。
(1)甲小组同学用足量的铝与50 mL盐酸发生反应,并用排水集气法收集反应放出的氢气,实验记录如下:
时间/min | 1 | 2 | 3 | 4 | 5 | 反应结束时 |
氢气体积/mL(标准状况下) | 50 | 150 | 300 | 380 | 410 | 560 |
①哪一时间段(即0~1、1~2、2~3、3~4、4~5 min)反应速率最大__,原因是____;
②反应进行到10 min时,便不再有气泡产生,该盐酸中HCl的物质的量浓度是__,整个反应过程中HCl的反应速率为____;
(2)乙小组学生也做了同样的实验,但由于反应太快,不好测量氢气体积,他事先在盐酸中加入等体积的下列液体:A.蒸馏水、B.KCl溶液、C.KNO3溶液、D.CuSO4溶液,以减慢反应速率,你认为可行的是____,不可行的理由是_________。