【题目】四氯化锡常作有机合成的催化剂。实验室用熔融的锡(熔点为231.9 ℃)与氯气反应制备SnCl4。装置如图所示(加热装置省略)。
已知:①SnCl4、SnCl2有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4在空气中极易水解生成SnO2·xH2O。
③在常温下,用KClO3和浓盐酸反应制备氯气。
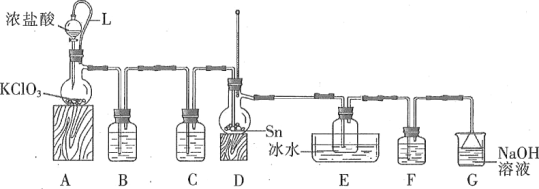
(1)写出装置A中发生反应的化学方程式:_____。
(2)下列说法不正确的是____。(填字母)
A.F和C中试剂相同,E中的冰水冷却产品
B.导管L平衡气压,使浓盐酸顺利下滴
C.先通入氯气,当D充满黄绿色气体时加热烧瓶
D.除去产品中氯气的方法是加入SnCl2溶液
(3)用化学方程式表示拆去F装置对实验的影响:_____。
(4)F和G装置可以用下列装置代替的是____。(填代号)
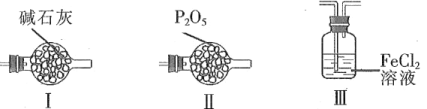
(5)加热D使锡熔融后需要继续加热,其一为了加快锡与氯气反应,其二为了____。
(6)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液VmL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量___(填“偏高”“偏低”或“无影响”)。
【题目】元素周期表中第三周期包括Na、Mg、Al、Si、P、S、Cl、Ar 8种元素。请回答下列问题:
(1)SCl2分子中的中心原子杂化轨道类型是_______,该分子构型为_________。
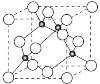
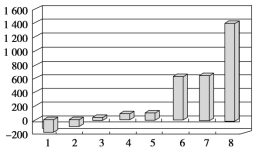
(2)第三周期8种元素按单质熔点(℃)大小顺序绘制的柱形图(已知柱形“1”代表Ar)如图所示,则其中“2”原子的结构示意图为____________,“8”原子的电子排布式为________________。
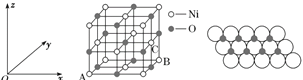
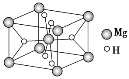
(3)氢化镁储氢材料的晶胞结构如图所示,已知该晶体的密度为ρ g·cm-3,则该晶体的化学式为__________,晶胞的体积为__________cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
则KCl、MgO、CaO三种晶体的熔点从高到低的顺序是________________。其中MgO晶体中一个Mg2+周围和它最近且等距离的Mg2+有________个。
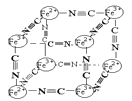
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中含有_______个σ键,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为______________。
),则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,其原因是__________________________________。
)的沸点在129~131℃之间,后者沸点较高,其原因是__________________________________。
(6)Si、C和O的成键情况如下:
化学键 | C—O | C===O | Si—O | Si===O |
360 | 803 | 464 | 640 |
C和O之间易形成含有双键的CO2分子晶体,而Si和O之间则易形成含有单键的SiO2原子晶体,请结合数据分析其原因:_______________________________________________________