【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH=___(填“<”、“>”或“=”)0。
(2)830℃时,向一个5 L的密闭容器中充入0.20molA和0.80molB,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=____mol·L-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____。
(3)判断该反应是否达到平衡的依据为_____。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
【题目】(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”)。
(2)基态Fe2+的电子排布式为___。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | … |
I0/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | … |
则该元素的元素符号是___。
(4)NO3-的空间构型__(用文字描述),SO42-中硫原子的杂化方式为___。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___、中心原子的杂化形式为___。根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___。
(6)与O3分子互为等电子体的一种阴离子为___(填化学式)。
(7)N2分子中σ键与π键的数目比n(σ):n(π)=___。
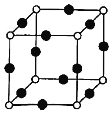
(8)Cu、N两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是___(用元素符号表示);若晶胞的棱长a nm,阿伏加德罗常数为NA,则该晶体的密度为___g/cm3(用含a、NA的式子表示)。