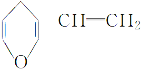【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

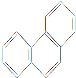
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
【题目】根据杂化轨道理论和价电子对互斥模型判断,下列分子或者离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥模型 | 分子或离子的立体构型 |
A. | SO2 | sp | 直线形 | 直线形 |
B. | HCHO | sp2 | 平面三角形 | 三角锥形 |
C. | NF3 | sp2 | 四面体形 | 平面三角形 |
D. |
| sp3 | 正四面体形 | 正四面体形 |
A. AB. BC. CD. D
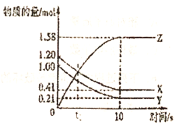
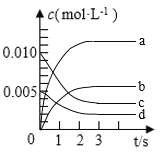
【题目】甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。在![]() 密闭容器内,
密闭容器内,![]() 时反应:
时反应:![]()
![]() ,体系中
,体系中![]() 随时间的变化如下表:
随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
| 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示![]() 的变化的曲线是________。
的变化的曲线是________。
(2)用![]() 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率![]() ________
________![]() 。
。
(3)能说明该反应已达到平衡状态的是________。
a.![]() 与
与![]() 的浓度保持不变 b.容器内密度保持不变
的浓度保持不变 b.容器内密度保持不变
c.容器内压强保持不变 d.每消耗![]() 的同时有
的同时有![]() 形成
形成
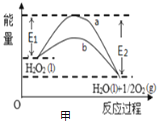
(4)已知常温常压下1g液态甲醇燃烧生成![]() 气体和液态水放出
气体和液态水放出![]() 的热量,则该反应的热化学方程式为________。
的热量,则该反应的热化学方程式为________。
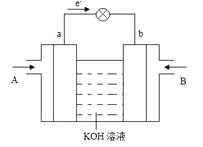
(5)![]() 与
与![]() 的反应可将化学能转化为电能,其工作原理如下图所示,图中
的反应可将化学能转化为电能,其工作原理如下图所示,图中![]() 从________(填A或B)通入。b电极反应式为________。
从________(填A或B)通入。b电极反应式为________。